1 . I.无水四氯化锡(SnCl4)用于制作FTO导电玻璃,FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等领域,可用如图所示装置制备四氯化锡。
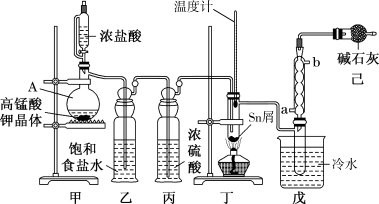
有关信息如下表所示:
(1)仪器A中发生反应的化学方程为_______ 。
(2)将装置按图示连接好,先检在装置的气密性,再慢慢滴入浓盐酸,待观察到装置丁内充满黄绿色气体后,开始加热装置丁。如果缺少装置乙,装置丁内还可能发生的副反应的化学方程式为_______ ,装置已的作用是_______ 。
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
i.实验需要90mL0.10mol·L-1FeBr2溶液
(3)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需要的玻璃仪器是_______ 。
(4)下列有关配制过程的说法正确的是_______(填序号)。
ii.探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(5)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;②四氯化碳(CCl4)不溶于水且密度比水大。
(6)若假设2正确,向20L上述浓度的FeBr2溶液中通入标准状况下56LCl2,反应的离子方程式为_______ 。

有关信息如下表所示:
| 化学式 | Sn | SnCl2 | SnCl4 |
| 熔点/°C | 232 | 247 | -34 |
| 沸点/°C | 2602 | 623 | 114 |
| 其他性质 | 银白色固体 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易溶于水并能与水反应 |
(2)将装置按图示连接好,先检在装置的气密性,再慢慢滴入浓盐酸,待观察到装置丁内充满黄绿色气体后,开始加热装置丁。如果缺少装置乙,装置丁内还可能发生的副反应的化学方程式为
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
i.实验需要90mL0.10mol·L-1FeBr2溶液
(3)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需要的玻璃仪器是
(4)下列有关配制过程的说法正确的是_______(填序号)。
| A.用托盘天平称量质量为1.944g的FeBr2 |
| B.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解 |
| C.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中 |
| D.容量瓶贴签存放配好的FeBr2溶液 |
ii.探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(5)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;②四氯化碳(CCl4)不溶于水且密度比水大。
| 实验步骤、预期现象 | 结论 |
| ①取适量溶液于试管中,向其中加入 现象:溶液分层,下层呈橙红色,上层呈无色 | 假设1正确 |
| ②另取适量溶液于试管中,向其中加入 现象:溶液变为红色 | 假设2正确 |
您最近一年使用:0次
名校
2 . 钠和氯的化合物常用于化工生产与生活中。
(1)将一小块钠放在水平放置的试管中部,用酒精灯加热至充分反应,化学方程式为_______ 。将试管冷却后加水,发生反应的离子方程式为_______ 。
(2)实验室欲用NaOH固体配制1.0mol/L的NaOH溶液480mL。
①完成本实验需要用托盘天平称量NaOH_______ g。
②在配制过程中,若其他操作都正确,下列操作会使浓度偏高的是_______ (填序号)。
A.定容时仰视刻度线 B.未冷就转移溶液
C.未洗涤烧杯和玻璃棒 D.NaOH已部分变质
(3) 将逐渐用来取代
将逐渐用来取代 成为自来水的消毒剂。已知
成为自来水的消毒剂。已知 是一种易溶于水难溶于有机物的气体,
是一种易溶于水难溶于有机物的气体, 等卤素单质在水中溶解度远小于在有机溶剂
等卤素单质在水中溶解度远小于在有机溶剂 中的溶解度。制备
中的溶解度。制备 的原理为
的原理为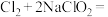
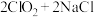 。实验装置如下图:
。实验装置如下图:

①装置A中发生反应的化学方程式为_______ 。
②E中加入的试剂可以是_______ (任意填一种)
③F用于收集 ,可选用
,可选用_______ (气流均左进右出)

④ 在消毒过程中被还原为
在消毒过程中被还原为 。
。 消毒效率是
消毒效率是 的
的_______ 倍。(消毒效率:单位质量消毒剂得到电子数,答案保留到小数点后一位。)
(1)将一小块钠放在水平放置的试管中部,用酒精灯加热至充分反应,化学方程式为
(2)实验室欲用NaOH固体配制1.0mol/L的NaOH溶液480mL。
①完成本实验需要用托盘天平称量NaOH
②在配制过程中,若其他操作都正确,下列操作会使浓度偏高的是
A.定容时仰视刻度线 B.未冷就转移溶液
C.未洗涤烧杯和玻璃棒 D.NaOH已部分变质
(3)
 将逐渐用来取代
将逐渐用来取代 成为自来水的消毒剂。已知
成为自来水的消毒剂。已知 是一种易溶于水难溶于有机物的气体,
是一种易溶于水难溶于有机物的气体, 等卤素单质在水中溶解度远小于在有机溶剂
等卤素单质在水中溶解度远小于在有机溶剂 中的溶解度。制备
中的溶解度。制备 的原理为
的原理为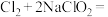
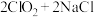 。实验装置如下图:
。实验装置如下图:
①装置A中发生反应的化学方程式为
②E中加入的试剂可以是
③F用于收集
 ,可选用
,可选用
④
 在消毒过程中被还原为
在消毒过程中被还原为 。
。 消毒效率是
消毒效率是 的
的
您最近一年使用:0次
2023-01-13更新
|
235次组卷
|
3卷引用:云南省宣威市第六中学2023-2024学年高一上学期12月月考化学试题
3 . 在实验室采用如图装置制备气体,合理的是
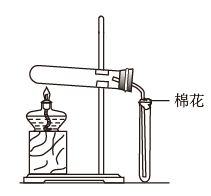
| 化学试剂 | 制备的气体 | |
| A | 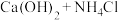 |  |
| B | 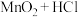 (浓) (浓) |  |
| C | 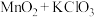 |  |
| D | 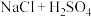 (浓) (浓) |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-09更新
|
21816次组卷
|
50卷引用:云南省开远市第一中学校2023-2024学年高一上学期9月半月考试化学试题
云南省开远市第一中学校2023-2024学年高一上学期9月半月考试化学试题2021年高考全国乙卷化学真题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题河北省辛集中学 2020-2021学年高二下学期期末考试化学试题(已下线)第29讲 化学综合实验(精练)-2022年高考化学一轮复习讲练测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)四川省眉山市彭山区第一中学2021-2022学年高二上学期入学考试化学试题宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)第29讲 常见气体的制备与性质实验(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)2021年高考全国乙卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习陕西省西北农林科技大学附属中学2021-2022学年高一上学期期末考试化学试题(已下线)秘籍04 实验仪器使用与基本操作-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押全国卷理综第9题 化学实验基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题11 基本实验专练(已下线)专题11化学实验基础-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)安徽省砀山县第四中学2022-2023学年高三上学期第一次月考化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题山西省实验中学2021-2022学年高二上学期开学考试化学试题安徽省六安市裕安区新安中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价第四章 非金属及其化合物 第24讲 常见气体的实验室制备、净化和收集(已下线)素养卷07 微型物质制备方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题04 常见气体的实验室制取(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)微专题 常见气体的实验室制备、净化和收集(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 物质制备实验的设计与评价章末知识整合黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
名校
解题方法
4 . Cl2O又称为次氯酸酐,是强氧化剂,易溶于水且与水反应,受热时容易燃烧、高浓度时容易爆炸。其熔沸点分别为-116℃和3.8℃;Cl2的沸点是-34.6℃。现利用HgO和Cl2以及以下装置制备Cl2O:

回答下列问题:
(1)仪器A的名称:___________ 。用酸性高锰酸钾制备Cl2应采用气体发生装置:___________ (填“甲”或“乙”)
(2)②、③中盛放的试剂分别是___________ 、___________ 。
(3)写出HgO和Cl2制备Cl2O的化学方程式:___________ 。
(4)通入干燥空气的目的是___________ 。
(5)实验装置存在一些不足,请指出___________ 。
(6)要想进一步分离得到Cl2O,采用的操作方法是:___________ 。

回答下列问题:
(1)仪器A的名称:
(2)②、③中盛放的试剂分别是
(3)写出HgO和Cl2制备Cl2O的化学方程式:
(4)通入干燥空气的目的是
(5)实验装置存在一些不足,请指出
(6)要想进一步分离得到Cl2O,采用的操作方法是:
您最近一年使用:0次
2021-07-14更新
|
811次组卷
|
7卷引用:云南省昌宁县第一中学2022-2023学年高一下学期期末考试化学试题
解题方法
5 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:_______ 、________ 。

(2)乙组同学利用甲组制得NO和Cl2制备NOCl,装置如图所示:
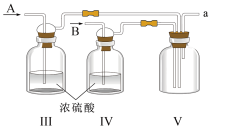

①装置连接顺序为a→________ (按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,从A处进入的气体是________ (填Cl2或NO)。实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是________ (回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________ 。
④装置Ⅵ的作用为________ ,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为________ 。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL.亚硝酰氯(NOCl)的质量分数为________ (用代数式表示即可)。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:

装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 反应漏斗中 | ||
| 制备纯净氯气 | 二氧化锰 | ①______ | 饱和食盐水 |
| 制备纯净一氧化氮 | 铜 | 稀硝酸 | ②______ |


①装置连接顺序为a→
②为了使气体充分反应,从A处进入的气体是
③装置Ⅴ生成NOCl的化学方程式是
④装置Ⅵ的作用为
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL.亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次



