名校
解题方法
1 . 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
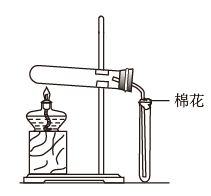
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______________ 。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是______________ ;丁装置中稀硫酸的作用是______________ 。
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从______________ 管通入 __________ 气体。
(4)有同学建议在戊装置的b管下端连接己装置,理由是______________ 。
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g 水):
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:______________ 。
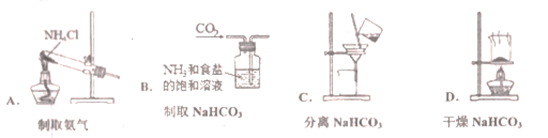
(6)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是______________ 。
(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是______________ (填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为______________ 。
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从
(4)有同学建议在戊装置的b管下端连接己装置,理由是
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g 水):
| 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(6)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是

(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为
您最近一年使用:0次
名校
2 . 下图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略):

回答下列问题:
(1)装置A中是用MnO2和浓盐酸反应制备Cl2,请写出其反应的化学方程式:___________ 。
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:___________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入:湿润的有色布条、___________ 、干燥的有色布条。
(4)装置E中潮湿的Cl2与Na2CO3反应,生成NaHCO3、Cl2O气体和另一种盐,试写出该反应的化学方程式:___________
(5)装置F的作用是:___________ 。
(6)反应G中的离子方程式为___________ 。
(7)设计最简单的实验方案验证E中生成的固体中存在HCO :
:___________ 。

回答下列问题:
(1)装置A中是用MnO2和浓盐酸反应制备Cl2,请写出其反应的化学方程式:
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入:湿润的有色布条、
(4)装置E中潮湿的Cl2与Na2CO3反应,生成NaHCO3、Cl2O气体和另一种盐,试写出该反应的化学方程式:
(5)装置F的作用是:
(6)反应G中的离子方程式为
(7)设计最简单的实验方案验证E中生成的固体中存在HCO
 :
:
您最近一年使用:0次
2021-11-27更新
|
138次组卷
|
2卷引用:河北省邢台市第一中学2021-2022学年高一上学期第二次月考化学试题
3 . 实验室由硫铁矿烧渣(主要成分为 、
、 、
、 )制备软磁性材料
)制备软磁性材料 。主要转化流程如下:
。主要转化流程如下:
①酸浸。写出烧渣酸浸时 与稀硫酸反应的化学方程式
与稀硫酸反应的化学方程式___________ 。
②还原。向“酸浸”后的溶液中加入过量铁粉,使 完全转化为
完全转化为 ,该过程除生成
,该过程除生成 外,还会生成
外,还会生成___________ (填化学式);检验 是否还原完全的实验操作是
是否还原完全的实验操作是___________ 。
③除杂。向“还原”后滤液中加入NaOH溶液,调节pH为___________ ,使 除去完全。[已知:
除去完全。[已知: 时
时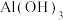 沉淀完全,
沉淀完全, 时
时 开始沉淀。]
开始沉淀。]
④结晶。结合题图所示的绿矾溶解度曲线,补充完整获得 晶体的实验操作。向
晶体的实验操作。向 溶液中再加入稀硫酸酸化,
溶液中再加入稀硫酸酸化,___________ ,过滤,少量冰水洗涤,低温干燥,得到 晶体。
晶体。 。将
。将 溶液与氨水
溶液与氨水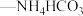 混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。___________ ;生成 的离子方程式为
的离子方程式为___________ 。
②生成的 沉淀需“洗涤完全”,检验方法是
沉淀需“洗涤完全”,检验方法是___________ 。
(3)制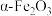 。将纯净的
。将纯净的 放入管式炉内煅烧2h,获得产品
放入管式炉内煅烧2h,获得产品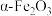 。下图为其他条件相同时不同煅烧温度对产品中
。下图为其他条件相同时不同煅烧温度对产品中 质量分数的影响,当煅烧温度高于800℃时,产品中
质量分数的影响,当煅烧温度高于800℃时,产品中 质量分数降低,铁元素质量分数升高,其可能原因是
质量分数降低,铁元素质量分数升高,其可能原因是___________ 。
 、
、 、
、 )制备软磁性材料
)制备软磁性材料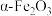 。主要转化流程如下:
。主要转化流程如下:
①酸浸。写出烧渣酸浸时
 与稀硫酸反应的化学方程式
与稀硫酸反应的化学方程式②还原。向“酸浸”后的溶液中加入过量铁粉,使
 完全转化为
完全转化为 ,该过程除生成
,该过程除生成 外,还会生成
外,还会生成 是否还原完全的实验操作是
是否还原完全的实验操作是③除杂。向“还原”后滤液中加入NaOH溶液,调节pH为
 除去完全。[已知:
除去完全。[已知: 时
时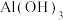 沉淀完全,
沉淀完全, 时
时 开始沉淀。]
开始沉淀。]④结晶。结合题图所示的绿矾溶解度曲线,补充完整获得
 晶体的实验操作。向
晶体的实验操作。向 溶液中再加入稀硫酸酸化,
溶液中再加入稀硫酸酸化, 晶体。
晶体。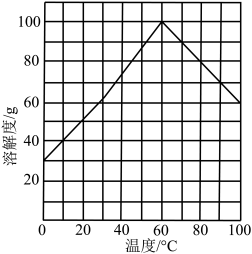
 。将
。将 溶液与氨水
溶液与氨水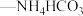 混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。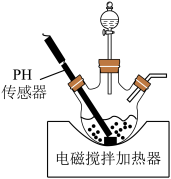
 的离子方程式为
的离子方程式为②生成的
 沉淀需“洗涤完全”,检验方法是
沉淀需“洗涤完全”,检验方法是(3)制
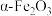 。将纯净的
。将纯净的 放入管式炉内煅烧2h,获得产品
放入管式炉内煅烧2h,获得产品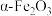 。下图为其他条件相同时不同煅烧温度对产品中
。下图为其他条件相同时不同煅烧温度对产品中 质量分数的影响,当煅烧温度高于800℃时,产品中
质量分数的影响,当煅烧温度高于800℃时,产品中 质量分数降低,铁元素质量分数升高,其可能原因是
质量分数降低,铁元素质量分数升高,其可能原因是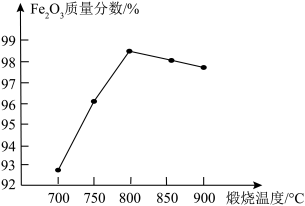
您最近一年使用:0次
2023-04-22更新
|
576次组卷
|
2卷引用:河北省秦皇岛市青龙满族自治县青龙部分学校2023-2024学年高一上学期1月期末联考化学试题
名校
解题方法
4 . SiCl4在室温下为无色液体,易挥发,遇水强烈水解,并放出大量热。实验室用Cl2与SiO2和C在加热条件下反应制备SiCl4,同时产生CO尾气,实验装置如表:

回答下列问题:
(1)仪器a的名称是____ 。
(2)该实验装置中合理的连接顺序为A→_____ →F;其中装置C的作用是____ ;装置F气球中主要收集到的气体是____ (填化学式)。
(3)装置A中发生反应的离子方程式为:_____ 。
(4)装置E的硬质玻璃管中反应的化学方程式为_____ ;将试管放入冰水混合物中的原因是____ 。
(5)氮化硅(Si3N4)是一种新型耐高温陶瓷材料,可以在高温条件下由SiCl4蒸气和NH3反应得到,写出该反应的化学方程式:____ 。

回答下列问题:
(1)仪器a的名称是
(2)该实验装置中合理的连接顺序为A→
(3)装置A中发生反应的离子方程式为:
(4)装置E的硬质玻璃管中反应的化学方程式为
(5)氮化硅(Si3N4)是一种新型耐高温陶瓷材料,可以在高温条件下由SiCl4蒸气和NH3反应得到,写出该反应的化学方程式:
您最近一年使用:0次
2022-09-28更新
|
123次组卷
|
2卷引用:河北省沧州市部分学校2022-2023学年高三上学期开学考试化学试题
5 . 为了探究氯水中次氯酸的漂白性,某同学设计并完成以下实验。

请回答下列问题:
(1)仪器a的名称是___________ 。
(2)写出 和水反应的离子方程式:
和水反应的离子方程式:___________ 。
(3)利用上图所示装置(部分夹持装置已省略)进行实验,关闭阀门A时,试管中的有色布条___________ (填“会”或“不会”)褪色;打开阀门A后,有色布条褪色,说明___________ 。
(4)该同学依据氯水中的成分,对此实验结论的严谨性提出质疑,并提出进一步探究盐酸是否具有漂白性。___________ (填“有”或“没有”)必要进行该探究,请说明理由:___________ 。
(5)若将装置中的蒸馏水改为石灰乳来制备漂白粉,写出氯气与石灰乳反应的化学方程式:________ ;漂白粉长时间暴露在空气中容易发生变质的原因为________ (结合化学方程式说明)。

请回答下列问题:
(1)仪器a的名称是
(2)写出
 和水反应的离子方程式:
和水反应的离子方程式:(3)利用上图所示装置(部分夹持装置已省略)进行实验,关闭阀门A时,试管中的有色布条
(4)该同学依据氯水中的成分,对此实验结论的严谨性提出质疑,并提出进一步探究盐酸是否具有漂白性。
(5)若将装置中的蒸馏水改为石灰乳来制备漂白粉,写出氯气与石灰乳反应的化学方程式:
您最近一年使用:0次
2023-12-04更新
|
337次组卷
|
5卷引用:河北省沧州市衡水市八校联盟2023-2024学年高一上学期11月期中考试化学试题
解题方法
6 . 氯酸锶[ ]为白色结晶粉末,可溶于水,微溶于酒精。它主要用于制造红色焰火。下图为实验室制取氯酸锶的实验装置图,请回答下列问题:
]为白色结晶粉末,可溶于水,微溶于酒精。它主要用于制造红色焰火。下图为实验室制取氯酸锶的实验装置图,请回答下列问题:

(1)仪器a的名称是___________ 。
(2)A中发生反应的离子方程式为___________ ,该反应中 作
作___________ 剂。
(3)装置B中所装试剂的名称为___________ ,其作用是___________ 。
(4)装置C中搅拌的目的是___________ ;装置C制备氯酸锶的反应为 ,若反应消耗
,若反应消耗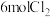 ,则转移电子的物质的量为
,则转移电子的物质的量为___________ mol。
(5)装置D的作用是___________ ;反应一段时间后,可观察到装置D中红色逐渐褪去,某实验小组的同学对红色突然褪去的原因进行猜想:
猜想一:氯水中的酸或氯分子与NaOH发生反应,将NaOH消耗所致。
猜想二:氯水中次氯酸的强氧化性,使红色褪去所致。
假如猜想一成立,请设计实验证明该猜想红色褪去的原因:___________ 。
 ]为白色结晶粉末,可溶于水,微溶于酒精。它主要用于制造红色焰火。下图为实验室制取氯酸锶的实验装置图,请回答下列问题:
]为白色结晶粉末,可溶于水,微溶于酒精。它主要用于制造红色焰火。下图为实验室制取氯酸锶的实验装置图,请回答下列问题:
(1)仪器a的名称是
(2)A中发生反应的离子方程式为
 作
作(3)装置B中所装试剂的名称为
(4)装置C中搅拌的目的是
 ,若反应消耗
,若反应消耗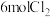 ,则转移电子的物质的量为
,则转移电子的物质的量为(5)装置D的作用是
猜想一:氯水中的酸或氯分子与NaOH发生反应,将NaOH消耗所致。
猜想二:氯水中次氯酸的强氧化性,使红色褪去所致。
假如猜想一成立,请设计实验证明该猜想红色褪去的原因:
您最近一年使用:0次
名校
7 . 实验室用H2还原WO3制备金属W的装置如图所示(焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是
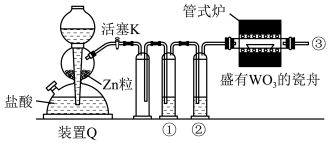

| A.①、②中依次盛装浓H2SO4、焦性没食子酸溶液 |
| B.管式炉加热前,用试管在③处收集气体并点燃,通过声音判断气体纯度 |
| C.结束反应时,先关闭活塞K,再停止加热 |
| D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 |
您最近一年使用:0次
2022-01-23更新
|
283次组卷
|
2卷引用:河北省张家口市宣化第一中学2022-2023学年高一上学期期中线上考试化学试题
名校
8 . 实验小组制备高铁酸钾( )并探究其性质。
)并探究其性质。
资料:i、 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
ii、含有 的盐溶液遇到
的盐溶液遇到 溶液时变成红色。
溶液时变成红色。
(1)制备 (夹持装置略)
(夹持装置略)
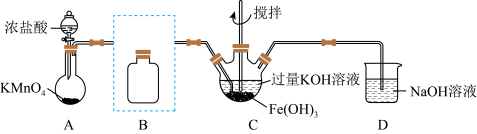
①A为氯气发生装置。
②将除杂装置B补充完整并标明所用试剂___________ 。
③C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有 ,另外还有
,另外还有___________ 。
(2)探究 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
ⅰ、由方案Ⅰ中溶液变红可知a中含有___________ ,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由___________ 产生(用离子方程式表示)。
ⅱ、方案Ⅱ可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是___________ 。
②根据 的制备实验得出:氧化性:
的制备实验得出:氧化性:
___________  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
③资料表明,酸性溶液中的氧化性: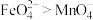 ,验证实验如下:溶液b滴入
,验证实验如下:溶液b滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:
的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性: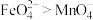 。
。
若能,请说明理由;若不能,进一步设计实验方案。理由或方案:___________ 。
 )并探究其性质。
)并探究其性质。资料:i、
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。ii、含有
 的盐溶液遇到
的盐溶液遇到 溶液时变成红色。
溶液时变成红色。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置。
②将除杂装置B补充完整并标明所用试剂
③C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有 ,另外还有
,另外还有(2)探究
 的性质
的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,滴加 溶液至过量,溶液呈红色 溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 产生 产生 |
 将
将 氧化,还可能由
氧化,还可能由ⅱ、方案Ⅱ可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是②根据
 的制备实验得出:氧化性:
的制备实验得出:氧化性:
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性:
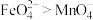 ,验证实验如下:溶液b滴入
,验证实验如下:溶液b滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:
的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性: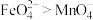 。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
9 . 在实验室采用如图装置制备气体,合理的是
| 化学试剂 | 制备的气体 | |
| A | 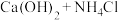 |  |
| B | 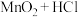 (浓) (浓) |  |
| C | 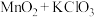 |  |
| D | 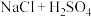 (浓) (浓) |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-09更新
|
21818次组卷
|
50卷引用:河北省辛集中学 2020-2021学年高二下学期期末考试化学试题
河北省辛集中学 2020-2021学年高二下学期期末考试化学试题2021年高考全国乙卷化学真题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题(已下线)第29讲 化学综合实验(精练)-2022年高考化学一轮复习讲练测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)四川省眉山市彭山区第一中学2021-2022学年高二上学期入学考试化学试题宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)第29讲 常见气体的制备与性质实验(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)2021年高考全国乙卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习陕西省西北农林科技大学附属中学2021-2022学年高一上学期期末考试化学试题(已下线)秘籍04 实验仪器使用与基本操作-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押全国卷理综第9题 化学实验基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题11 基本实验专练(已下线)专题11化学实验基础-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)安徽省砀山县第四中学2022-2023学年高三上学期第一次月考化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题山西省实验中学2021-2022学年高二上学期开学考试化学试题安徽省六安市裕安区新安中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价第四章 非金属及其化合物 第24讲 常见气体的实验室制备、净化和收集(已下线)素养卷07 微型物质制备方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题04 常见气体的实验室制取(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)微专题 常见气体的实验室制备、净化和收集(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)云南省开远市第一中学校2023-2024学年高一上学期9月半月考试化学试题(已下线)第3讲 物质制备实验的设计与评价章末知识整合黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
解题方法
10 . 水合肼(N2H4•H2O)是一种在生产生活中有着广泛用途的精细化工原料,具有强碱性和强还原性。实验室一般采用次氯酸钠(受热易分解)氧化尿素( )制备水合肼,制备过程可分为两个阶段:
)制备水合肼,制备过程可分为两个阶段:
(第一阶段)制备次氯酸钠。
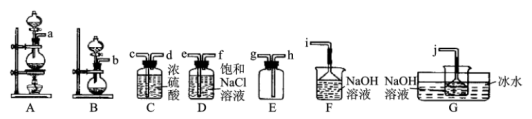
(1)某同学欲从图中选择部分装置,收集一瓶干燥的氯气,其连接次序为:a→__ (按气流方向,用小写字母表示)。
(2)实验中选用G装置作为次氯酸钠的合成装置,并采用冰水浴的原因是__ 。
(第二阶段)制备水合肼。
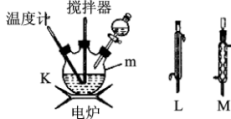
将第一阶段制备的次氯酸钠碱性溶液转移至分液漏斗中,慢慢滴加到盛有尿素的仪器m中,并不断搅拌;然后取下分液漏斗换上X装置,快速升温,在108℃的条件下回流5min;将混合物转移到蒸馏装置中进行蒸馏,收集108~114℃馏分,得水合肼产品。
(3)请写出此阶段制备水合肼的离子反应方程式___ 。
(4)X装置最好选用图中的___ (填“L”或“M”)。
(5)用分液漏斗加入次氯酸钠碱性溶液时,慢慢滴加的目的是__ 。
(6)水合肼还原法制取碘化钠固体,其制备流程如图所示:
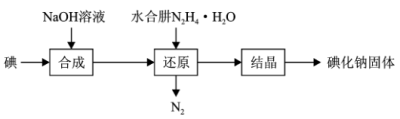
在“还原”过程中,主要消耗“合成”过程中生成的副产物IO ,该过程的化学方程式为
,该过程的化学方程式为__ 。工业上也可用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是__ 。
 )制备水合肼,制备过程可分为两个阶段:
)制备水合肼,制备过程可分为两个阶段:(第一阶段)制备次氯酸钠。

(1)某同学欲从图中选择部分装置,收集一瓶干燥的氯气,其连接次序为:a→
(2)实验中选用G装置作为次氯酸钠的合成装置,并采用冰水浴的原因是
(第二阶段)制备水合肼。

将第一阶段制备的次氯酸钠碱性溶液转移至分液漏斗中,慢慢滴加到盛有尿素的仪器m中,并不断搅拌;然后取下分液漏斗换上X装置,快速升温,在108℃的条件下回流5min;将混合物转移到蒸馏装置中进行蒸馏,收集108~114℃馏分,得水合肼产品。
(3)请写出此阶段制备水合肼的离子反应方程式
(4)X装置最好选用图中的
(5)用分液漏斗加入次氯酸钠碱性溶液时,慢慢滴加的目的是
(6)水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗“合成”过程中生成的副产物IO
 ,该过程的化学方程式为
,该过程的化学方程式为
您最近一年使用:0次
2021-03-17更新
|
320次组卷
|
2卷引用:河北省保定市2020-2021学年高三上学期期末考试化学试题



