名校
解题方法
1 . 下列离子反应方程式正确的是
A.氯气通入冷的石灰乳: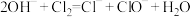 |
B.向NaHCO3溶液中滴入少量澄清石灰水: |
C.向明矾溶液中滴加Ba(OH)2溶液到 恰好完全沉淀时: 恰好完全沉淀时: |
| D.向FeI2溶液中通入少量氯气:Cl2 + 2I- = 2Cl- + I2 |
您最近半年使用:0次
名校
2 . 某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠溶液反应):
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是___________ (填序号)。
(2)测定过程中发生反应的离子方程式为:___________ 、___________ 。
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
①配制上述的稀盐酸时,需要选取的主要玻璃仪器有酸式滴定管(可量取液体体积精确到0.01mL的仪器)、烧杯、玻璃棒、___________ 。
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是___________ 。
③下列操作会导致配制的盐酸浓度偏低的是___________ 。
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为___________ 。
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为:
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.02 | 13.22 | 12.98 | 13.00 |
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是
③下列操作会导致配制的盐酸浓度偏低的是
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为
您最近半年使用:0次
解题方法
3 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)现有铁和铜的混合物,可以通过___________ 把他们分开。
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:___________ 。
反应后的废液中含有Fe3+,可以用___________ 检验。
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。___________ ,黄绿色气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式___________ 。
(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,___________ (补全实验现象),此过程涉及氧化还原反应的化学方程式是___________ 。
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________ 。
(1)现有铁和铜的混合物,可以通过
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:
反应后的废液中含有Fe3+,可以用
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
您最近半年使用:0次
解题方法
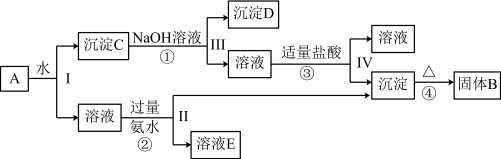
4 . 某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是___________ 。
(2)写出KAl(SO4)2在水中的电离方程式___________ 。
(3)已知H+ +[Al(OH)4]- = Al(OH)3↓+ H2O,根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B___________ ;沉淀D___________ ;溶液E是K2SO4和___________ 。
(4)写出①②反应的离子方程式。
①___________ 。
②___________ 。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
(2)写出KAl(SO4)2在水中的电离方程式
(3)已知H+ +[Al(OH)4]- = Al(OH)3↓+ H2O,根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B
(4)写出①②反应的离子方程式。
①
②
您最近半年使用:0次
5 . 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表列出了七种元素在元素周期表中的位置,回答下列问题:
(1)表中C在周期表的位置是___________ 。
(2)元素E与元素H相比,金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ (填字母序号)。
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:___________ ;画出氧离子的结构示意图:___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | ||||||
| 4 | H |
(2)元素E与元素H相比,金属性较强的是
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:
您最近半年使用:0次
解题方法
6 . 氯化钠是日常生活必需品和重要的化工原料。
(1)NaCl固体是否属于电解质?______ ,是否能导电?______ (填写“是”或“否”)。
(2)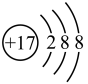 表示
表示______ 。
A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO 等可溶性杂质。
等可溶性杂质。
①写出NaCl溶于水时的电离方程式______ 。
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和______ 。
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为_______ 。
如图是某品牌“84消毒液”的使用注意事项。
②注意事项4“易使有色衣物脱色”,是因为“84消毒液”具有______ 。
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式_______ 。
(1)NaCl固体是否属于电解质?
(2)
 表示
表示A.氯原子的结构示意图
B.氯离子的结构示意图
(3)实验室提纯粗盐时,将粗盐溶于水后,先除去泥沙等难溶性杂质,再除去Ca2+、Mg2+、SO
 等可溶性杂质。
等可溶性杂质。①写出NaCl溶于水时的电离方程式
②为了除去可溶性杂质,依次加入稍过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,加热至70℃左右约2min,冷却后过滤,得到的沉淀有BaSO4、Mg(OH)2、CaCO3和
(4)“84消毒液”是常见的消毒剂,其有效成分是NaClO。
①Cl2和NaOH制备NaClO的离子方程式为
如图是某品牌“84消毒液”的使用注意事项。
| 注意事项 1、外用消毒液,勿口服; 2、现用现配,使用时注意戴手套防护; 3、不适用于钢和铝制品的消毒; 4、易使有色衣物脱色; 5、避光、阴凉处保存; 6、不可与酸性物质同时使用. |
A.碱性 B.强氧化性
③注意事项6“不可与酸性物质同时使用”,例如,若将“84消毒液”与“洁厕灵”(含盐酸)同时使用会生成黄绿色有毒气体。写出反应的离子方程式
您最近半年使用:0次
解题方法
7 . 铁及其化合物在生产、生活中有重要作用。回答下列问题:
I.硫酸亚铁晶体 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:

(1)证明经步骤①得到的滤液中含有 的方法如下:取样,先滴加
的方法如下:取样,先滴加___________ ,再滴加少量氯水,该过程的现象为___________ 。
(2)步骤②加入氯水发生反应的离子方程式是___________ 。
(3)步骤③产生的红褐色物质成分是___________ (写化学式)。
(4)步骤④中一系列操作为___________ 、洗涤、干燥、灼烧。
(5)若所取补血剂质量为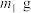 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为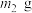 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为___________ (用含 、
、 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。
II.高铁酸钾 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:

(6)过程①制取1mol ,理论上需要
,理论上需要 物质的量为
物质的量为___________ ,步骤②中反应能够发生的原因是___________ ,分离出 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有___________ 。
I.硫酸亚铁晶体
 在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
在医药上常用作补血剂。某课外小组的同学通过实验测定补血剂中硫酸亚铁晶体的质量分数,实验步骤如图所示:
(1)证明经步骤①得到的滤液中含有
 的方法如下:取样,先滴加
的方法如下:取样,先滴加(2)步骤②加入氯水发生反应的离子方程式是
(3)步骤③产生的红褐色物质成分是
(4)步骤④中一系列操作为
(5)若所取补血剂质量为
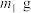 ,最终得到红棕色固体C的质量为
,最终得到红棕色固体C的质量为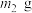 ,则补血剂中硫酸亚铁晶体的质量分数为
,则补血剂中硫酸亚铁晶体的质量分数为 、
、 的代数式表示,不考虑实验中铁元素的损失)。
的代数式表示,不考虑实验中铁元素的损失)。II.高铁酸钾
 是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
(6)过程①制取1mol
 ,理论上需要
,理论上需要 物质的量为
物质的量为 固体的操作中使用的玻璃仪器有
固体的操作中使用的玻璃仪器有
您最近半年使用:0次
8 . 三氯化铬是有机金属化学中的重要原料,为紫色晶体,熔点为83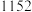 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到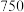 ℃时可制取
℃时可制取 ,同时还生成
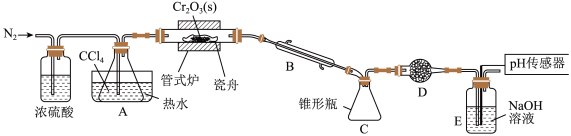
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知: 沸点
沸点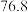 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。
Ⅰ.制备 :
:
(1)仪器 的名称是
的名称是______ 。
(2)装置 、
、 的作用分别是
的作用分别是______ 、______ 。
(3)实验前先通入一段时间 的目的是
的目的是______ 。
(4)制备 的化学方程式为
的化学方程式为______ 。
(5)判断反应结束的依据是______ 。
Ⅱ.测定 纯度:
纯度:
称取 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液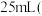 已知
已知 被
被 还原为
还原为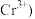 。
。
(6) 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为______ 。
(7)产品中 的纯度为
的纯度为______  杂质不参与反应
杂质不参与反应 。
。
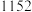 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到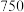 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知:
 沸点
沸点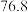 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。Ⅰ.制备
 :
:(1)仪器
 的名称是
的名称是(2)装置
 、
、 的作用分别是
的作用分别是(3)实验前先通入一段时间
 的目的是
的目的是(4)制备
 的化学方程式为
的化学方程式为(5)判断反应结束的依据是
Ⅱ.测定
 纯度:
纯度:称取
 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液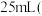 已知
已知 被
被 还原为
还原为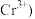 。
。(6)
 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为(7)产品中
 的纯度为
的纯度为 杂质不参与反应
杂质不参与反应 。
。
您最近半年使用:0次
解题方法
9 . 某小组为测定氯化铝样品(只含少量氯化铜杂质)的纯度,设计了以下实验方案:
步骤1:称取15.06g样品,用适量蒸馏水溶解;
步骤2:加入足量稀NaOH溶液,充分反应后过滤;
步聚5:洗涤所得沉淀并60℃水浴烘干至恒重,记录干燥的沉淀质量为0.98g;
步骤4:计算样品纯度。
已知:氢氧化铜难溶于稀氢氧化钠溶液且在80℃时会分解。回答下列问题:
(1)步骤1中需使用的仪器如下:
A. B.
B.  C.
C.  D.
D. 
仪器C的作用是___________ ,仪器D的名称是___________ 。
(2)写出步骤2中AlCl3发生反应的离子方程式___________ 。
(3)①如图洗涤沉淀的操作有何错误___________ ;
②证明沉淀已洗净的实验操作是___________ ;
③采用60℃水浴洪干沉淀的目的是___________ 。

(4)该氯化铝样品的纯度为___________ (保留两位有效数字)。
(5)步骤2中若用足量的浓氨水代替氢氧化钠溶液也可以测定样品中氯化铝的含量,理由是___________ 。
步骤1:称取15.06g样品,用适量蒸馏水溶解;
步骤2:加入足量稀NaOH溶液,充分反应后过滤;
步聚5:洗涤所得沉淀并60℃水浴烘干至恒重,记录干燥的沉淀质量为0.98g;
步骤4:计算样品纯度。
已知:氢氧化铜难溶于稀氢氧化钠溶液且在80℃时会分解。回答下列问题:
(1)步骤1中需使用的仪器如下:
A.
 B.
B.  C.
C.  D.
D. 
仪器C的作用是
(2)写出步骤2中AlCl3发生反应的离子方程式
(3)①如图洗涤沉淀的操作有何错误
②证明沉淀已洗净的实验操作是
③采用60℃水浴洪干沉淀的目的是

(4)该氯化铝样品的纯度为
(5)步骤2中若用足量的浓氨水代替氢氧化钠溶液也可以测定样品中氯化铝的含量,理由是
您最近半年使用:0次
名校
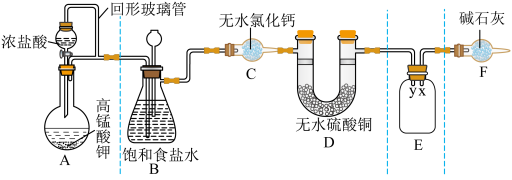
10 . 某同学用 与浓盐酸反应制备纯净的
与浓盐酸反应制备纯净的 的装置如图所示。回答下列问题:
的装置如图所示。回答下列问题:
已知: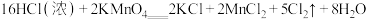
(1)装置A中盛放浓盐酸的仪器名称是
(2)E装置中导管(填“x”或“y”)
(3)装置F的作用有两个:一是
请写出氯气与碱石灰反应的化学方程式
(4)
 、HClO和
、HClO和 三种微粒的物质的量分数随pH(即
三种微粒的物质的量分数随pH(即 )变化的关系如图所示。
)变化的关系如图所示。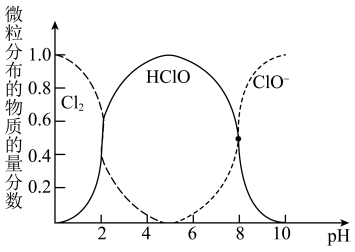
回答问题:①使用84消毒液时为增强消毒效果常调节4<pH<6,原因是
②通常购买的84消毒液pH在12左右,为增强消毒效果可向其中滴加
A.可口可乐 B.稀 C.食醋 D.浓盐酸
C.食醋 D.浓盐酸
(5)实验室将
 通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为
通入质量分数40%的NaOH溶液中来制备84消毒液。当NaOH消耗一半时转移电子数为 ,计算此时所得溶液中NaClO的质量分数为
,计算此时所得溶液中NaClO的质量分数为
您最近半年使用:0次



