1 . 三氯化铬是有机金属化学中的重要原料,为紫色晶体,熔点为83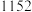 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到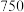 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
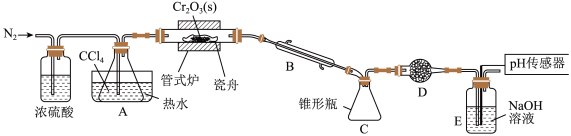
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知: 沸点
沸点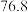 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。
Ⅰ.制备 :
:
(1)仪器 的名称是
的名称是______ 。
(2)装置 、
、 的作用分别是
的作用分别是______ 、______ 。
(3)实验前先通入一段时间 的目的是
的目的是______ 。
(4)制备 的化学方程式为
的化学方程式为______ 。
(5)判断反应结束的依据是______ 。
Ⅱ.测定 纯度:
纯度:
称取 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液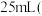 已知
已知 被
被 还原为
还原为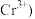 。
。
(6) 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为______ 。
(7)产品中 的纯度为
的纯度为______  杂质不参与反应
杂质不参与反应 。
。
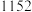 ℃,易潮解,高温下易被氧气氧化。实验室用
℃,易潮解,高温下易被氧气氧化。实验室用 和
和 加热到
加热到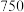 ℃时可制取
℃时可制取 ,同时还生成
,同时还生成 ,其装置图如下
,其装置图如下 加热及夹持装置略去
加热及夹持装置略去 ,请回答下列问题:
,请回答下列问题:
已知:
 沸点
沸点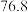 ℃;
℃; 有毒,沸点
有毒,沸点 ℃,遇水剧烈水解生成刺激性气味的气体。
℃,遇水剧烈水解生成刺激性气味的气体。Ⅰ.制备
 :
:(1)仪器
 的名称是
的名称是(2)装置
 、
、 的作用分别是
的作用分别是(3)实验前先通入一段时间
 的目的是
的目的是(4)制备
 的化学方程式为
的化学方程式为(5)判断反应结束的依据是
Ⅱ.测定
 纯度:
纯度:称取
 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,并小火加热,使
溶液,并小火加热,使 元素完全转化为
元素完全转化为 ;继续加热一段时间,冷却后配制成
;继续加热一段时间,冷却后配制成 溶液;取出
溶液;取出 ,滴加适量硫酸酸化后,用新配制的
,滴加适量硫酸酸化后,用新配制的 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液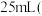 已知
已知 被
被 还原为
还原为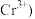 。
。(6)
 被
被 氧化成
氧化成 的离子方程式为
的离子方程式为(7)产品中
 的纯度为
的纯度为 杂质不参与反应
杂质不参与反应 。
。
您最近一年使用:0次
解题方法
2 . 某小组为测定氯化铝样品(只含少量氯化铜杂质)的纯度,设计了以下实验方案:
步骤1:称取15.06g样品,用适量蒸馏水溶解;
步骤2:加入足量稀NaOH溶液,充分反应后过滤;
步聚5:洗涤所得沉淀并60℃水浴烘干至恒重,记录干燥的沉淀质量为0.98g;
步骤4:计算样品纯度。
已知:氢氧化铜难溶于稀氢氧化钠溶液且在80℃时会分解。回答下列问题:
(1)步骤1中需使用的仪器如下:
A. B.
B.  C.
C.  D.
D. 
仪器C的作用是___________ ,仪器D的名称是___________ 。
(2)写出步骤2中AlCl3发生反应的离子方程式___________ 。
(3)①如图洗涤沉淀的操作有何错误___________ ;
②证明沉淀已洗净的实验操作是___________ ;
③采用60℃水浴洪干沉淀的目的是___________ 。

(4)该氯化铝样品的纯度为___________ (保留两位有效数字)。
(5)步骤2中若用足量的浓氨水代替氢氧化钠溶液也可以测定样品中氯化铝的含量,理由是___________ 。
步骤1:称取15.06g样品,用适量蒸馏水溶解;
步骤2:加入足量稀NaOH溶液,充分反应后过滤;
步聚5:洗涤所得沉淀并60℃水浴烘干至恒重,记录干燥的沉淀质量为0.98g;
步骤4:计算样品纯度。
已知:氢氧化铜难溶于稀氢氧化钠溶液且在80℃时会分解。回答下列问题:
(1)步骤1中需使用的仪器如下:
A.
 B.
B.  C.
C.  D.
D. 
仪器C的作用是
(2)写出步骤2中AlCl3发生反应的离子方程式
(3)①如图洗涤沉淀的操作有何错误
②证明沉淀已洗净的实验操作是
③采用60℃水浴洪干沉淀的目的是

(4)该氯化铝样品的纯度为
(5)步骤2中若用足量的浓氨水代替氢氧化钠溶液也可以测定样品中氯化铝的含量,理由是
您最近一年使用:0次
3 . 某实验小组在实验室制备氢氧化亚铁。
(一)制备氢氧化亚铁

(1)仪器g的名称是_______ ,选择上图中的装置制备氢氧化亚铁,连接顺序为_______ (按气流方向,用装置字母表示)。
(2)反应结束后继续通一段时间的N2,目的是_______ ,装置B中发生反应的离子方程式是_______ ,装置C的作用是_______ 。
(二)探究灰绿色沉淀的成因
反应后将装置B中固体过滤时白色沉淀会逐渐转变为灰绿色,实验小组为探究灰绿色沉淀的成因,查阅到以下资料:
i.Fe(OH)2沉淀具有较强的吸附性;
ii.若存在固体杂质,会导致Fe(OH)2沉淀不够紧密,沉淀与溶液的接触面积会更大。
甲同学猜测灰绿色可能是Fe(OH)2吸附Fe2+引起的,设计并完成了实验1~实验3。
(3)依据甲同学的猜测,实验1中沉淀无灰绿色的原因为_______ 。
(4)实验3中立即出现灰绿色浑浊的原因为_______ 。
(5)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件除了隔绝氧气外还有_______ 。
(一)制备氢氧化亚铁

(1)仪器g的名称是
(2)反应结束后继续通一段时间的N2,目的是
(二)探究灰绿色沉淀的成因
反应后将装置B中固体过滤时白色沉淀会逐渐转变为灰绿色,实验小组为探究灰绿色沉淀的成因,查阅到以下资料:
i.Fe(OH)2沉淀具有较强的吸附性;
ii.若存在固体杂质,会导致Fe(OH)2沉淀不够紧密,沉淀与溶液的接触面积会更大。
甲同学猜测灰绿色可能是Fe(OH)2吸附Fe2+引起的,设计并完成了实验1~实验3。
| 实验 | 操作 | 试剂(均为0.1mol/L) | 实验现象 |
| 1 | 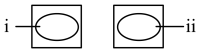 向两片玻璃片中心分别滴加试剂,面对面快速夹紧 | i.1滴FeSO4溶液 ii.4滴NaOH溶液 | 玻璃片夹缝中有白色浑浊 |
| 2 | i.4滴FeSO4溶液 ii.1滴NaOH溶液 | 玻璃片夹缝中有白色浑浊,一段时间后变为灰绿色 | |
| 3 | i.2滴FeSO4溶液, 1滴Fe2(SO4)3溶液 ii.2滴NaOH溶液 | 玻璃片夹缝中立即有灰绿色浑浊 |
(3)依据甲同学的猜测,实验1中沉淀无灰绿色的原因为
(4)实验3中立即出现灰绿色浑浊的原因为
(5)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件除了隔绝氧气外还有
您最近一年使用:0次
解题方法
4 . 实验小组探究Cu和 溶液的反应原理。
溶液的反应原理。
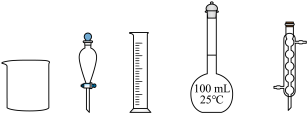
(1)配制溶液
用 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有_______ (填名称)。
(2)测定 溶液的pH
溶液的pH
用_______ (填仪器名称)测得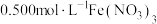 溶液的pH为1.10。
溶液的pH为1.10。
(3)提出假设
假设ⅰ:_______ ,反应的离子方程式为:
假设ⅱ: 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向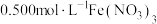 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加_______ (填化学式)溶液,观察到_______ 的实验现象,证明了反应中有 生成。
生成。
实验Ⅱ:向pH=1.10的_______ (填化学式)溶液中加入过量铜粉并充分振荡,无明显现象。
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设_______ (填“ⅰ”或“ⅱ”)成立。
(5)查阅资料知,铜粉与 溶液可能涉及的反应有;
溶液可能涉及的反应有;
反应①: ;
;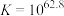 ;速率很慢。
;速率很慢。
反应②: ;
;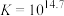 ,速率较快。
,速率较快。
反应③: ;
;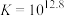 ;速率很快。
;速率很快。
反应④: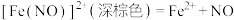
(a)对反应①来说, 起到的作用为
起到的作用为_______ ;为验证这一作用,设计的实验方案为_______ 。
(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到 的存在,原因是
的存在,原因是_______ 。
 溶液的反应原理。
溶液的反应原理。(1)配制溶液
用
 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有
(2)测定
 溶液的pH
溶液的pH用
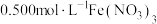 溶液的pH为1.10。
溶液的pH为1.10。(3)提出假设
假设ⅰ:

假设ⅱ:
 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向
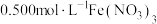 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加 生成。
生成。实验Ⅱ:向pH=1.10的
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设
(5)查阅资料知,铜粉与
 溶液可能涉及的反应有;
溶液可能涉及的反应有;反应①:
 ;
;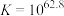 ;速率很慢。
;速率很慢。反应②:
 ;
;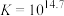 ,速率较快。
,速率较快。反应③:
 ;
;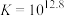 ;速率很快。
;速率很快。反应④:
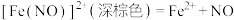
(a)对反应①来说,
 起到的作用为
起到的作用为(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到
 的存在,原因是
的存在,原因是
您最近一年使用:0次
名校
5 . 三个密闭容器分别装有A.Na2O2和NaHCO3, B.Na2O2和NH4HCO3, C.Na2O2和Ca(HCO3)2,其中每种物质均为1mol。将它们加热至300℃,充分反应后排出气体。
(1)写出各容器中残余物质的化学式及物质的量。
A._____ ; B._____ ; C._____ 。
(2)如果分别加入相同浓度的足量盐酸与残留物完全反应,则消耗盐酸的体积由大到小的顺序是_____ 。
(3)如果分别将A、B、C中原物质加入水中完全反应后溶质分别是什么?现象如何?
A:_____ ; B:_____ ; C:_____ 。
(1)写出各容器中残余物质的化学式及物质的量。
A.
(2)如果分别加入相同浓度的足量盐酸与残留物完全反应,则消耗盐酸的体积由大到小的顺序是
(3)如果分别将A、B、C中原物质加入水中完全反应后溶质分别是什么?现象如何?
A:
您最近一年使用:0次
6 . 草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水可溶于稀硫酸的固体,具有较强还原性,受热易分解,是生产电池、涂料以及感光材料的原材料。某化学活动小组分别设计了相应装置进行草酸亚铁的制备及其性质实验。回答下列问题:
Ⅰ.制备草酸亚铁晶体(装置如图所示):

(1)盛装稀硫酸的仪器名称为_____________________ 。
(2)实验过程:待 中反应一段时间后,需要对开关进行的操作是
中反应一段时间后,需要对开关进行的操作是_________ 。
(3)装置 的作用
的作用 _________________________ 。
Ⅱ.草酸亚铁晶体热分解产物的探究:

(4)装置C和D可以可以合并为一个盛有_________________ 的球形干燥管。
(5)从绿色化学考虑,该套装置存在的明显缺陷是_________________ 。
(6)实验结束后,E中黑色固体变为红色,B、F中澄清石灰水变浑浊,a中无水硫酸变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为__________ 。
Ⅲ. 运用热重分析法推测产物
称取3.60g草酸亚铁晶体加热分解,得到剩余固体质量随温度变化的曲线如图所示:

(7)当剩余固体质量为1.60g时,,剩余固体物质的化学式为__________ 。
Ⅰ.制备草酸亚铁晶体(装置如图所示):

(1)盛装稀硫酸的仪器名称为
(2)实验过程:待
 中反应一段时间后,需要对开关进行的操作是
中反应一段时间后,需要对开关进行的操作是(3)装置
 的作用
的作用 Ⅱ.草酸亚铁晶体热分解产物的探究:

(4)装置C和D可以可以合并为一个盛有
(5)从绿色化学考虑,该套装置存在的明显缺陷是
(6)实验结束后,E中黑色固体变为红色,B、F中澄清石灰水变浑浊,a中无水硫酸变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为
Ⅲ. 运用热重分析法推测产物
称取3.60g草酸亚铁晶体加热分解,得到剩余固体质量随温度变化的曲线如图所示:

(7)当剩余固体质量为1.60g时,,剩余固体物质的化学式为
您最近一年使用:0次
解题方法
7 . 过氧化钙水合物( ,x>2)微溶于水,能溶于酸,
,x>2)微溶于水,能溶于酸, 性质与
性质与 相似,可用作医用防腐剂和消毒剂。实验室制备过氧化钙的流程如下:
相似,可用作医用防腐剂和消毒剂。实验室制备过氧化钙的流程如下:

回答下列问题:
(1)步骤Ⅰ中应过量的试剂为______ (填“稀盐酸”或“碳酸钙”)。
(2)步骤Ⅱ中发生反应的离子方程式为___________ 。
(3)步骤Ⅴ烘干的同时计算确定水合物中x的值。从下列仪器中选出步骤Ⅴ中所需仪器为______ (填标号)。

过程中需至少称量_____ 次;当_____ 时可认为烘干完全。
(4)利用如图装置(夹持装置省略)测定产品中 的纯度。常温常压下,称取mg产品,记录量气管起始读数为5.00mL,从分液漏斗中迅速加入15.00mL的盐酸(足量)后,立即关闭旋塞。恢复至室温后,调整量气管读数为40.00mL。
的纯度。常温常压下,称取mg产品,记录量气管起始读数为5.00mL,从分液漏斗中迅速加入15.00mL的盐酸(足量)后,立即关闭旋塞。恢复至室温后,调整量气管读数为40.00mL。

仪器A的名称是_______ ;室温下气体摩尔体积为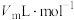 ,该产品的纯度为
,该产品的纯度为______ %(用含m、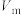 的代数式表示);若读数时,未调平水准管与量气管的液面,所测定产品的纯度会
的代数式表示);若读数时,未调平水准管与量气管的液面,所测定产品的纯度会______ (填“偏高”“偏低”或“无影响”)。
 ,x>2)微溶于水,能溶于酸,
,x>2)微溶于水,能溶于酸, 性质与
性质与 相似,可用作医用防腐剂和消毒剂。实验室制备过氧化钙的流程如下:
相似,可用作医用防腐剂和消毒剂。实验室制备过氧化钙的流程如下:
回答下列问题:
(1)步骤Ⅰ中应过量的试剂为
(2)步骤Ⅱ中发生反应的离子方程式为
(3)步骤Ⅴ烘干的同时计算确定水合物中x的值。从下列仪器中选出步骤Ⅴ中所需仪器为

过程中需至少称量
(4)利用如图装置(夹持装置省略)测定产品中
 的纯度。常温常压下,称取mg产品,记录量气管起始读数为5.00mL,从分液漏斗中迅速加入15.00mL的盐酸(足量)后,立即关闭旋塞。恢复至室温后,调整量气管读数为40.00mL。
的纯度。常温常压下,称取mg产品,记录量气管起始读数为5.00mL,从分液漏斗中迅速加入15.00mL的盐酸(足量)后,立即关闭旋塞。恢复至室温后,调整量气管读数为40.00mL。
仪器A的名称是
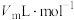 ,该产品的纯度为
,该产品的纯度为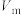 的代数式表示);若读数时,未调平水准管与量气管的液面,所测定产品的纯度会
的代数式表示);若读数时,未调平水准管与量气管的液面,所测定产品的纯度会
您最近一年使用:0次
名校
8 . W、X、Y是三种短周期主族元素且分别位于三个周期,X和Y位于同一主族且原子序数存在2倍关系。 (M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
(M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是

 (M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
(M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
| A.X和Y的简单氢化物稳定性:X>Y |
| B.W和金属钠形成的化合物为离子化合物 |
| C.最终曲线Q所得到的物质为Z3X4 |
D.热重曲线的第1、2、3个拐点失去的都是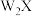 |
您最近一年使用:0次
2024-01-09更新
|
455次组卷
|
3卷引用:新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题
新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)广西钦州市第四中学2023-2024学年高一上学期12月考试化学试卷
名校
解题方法
9 . 制备某无机化合物的转化流程如图所示,下列说法错误的是


A.该转化流程中 均被循环使用,是催化剂 均被循环使用,是催化剂 |
| B.该循环过程中未涉及氧化还原反应 |
C.存在反应 |
| D.该工艺是利用食盐和石灰石制取纯碱 |
您最近一年使用:0次
2024-01-07更新
|
95次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期期中考试卷(化学)
23-24高一上·河南·阶段练习
名校
解题方法
10 . 聚合硫酸铁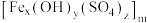 (铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
(铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
①称取一定质量的聚合硫酸铁,配成 溶液。
溶液。
②准确量取①中溶液 于烧杯中,加入足量的盐酸酸化的
于烧杯中,加入足量的盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体 。
。
③准确量取①中溶液 于烧杯中,加入足量的
于烧杯中,加入足量的 溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体
溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体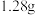 。
。
该聚合硫酸铁组成中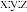 为
为
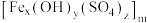 (铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
(铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:①称取一定质量的聚合硫酸铁,配成
 溶液。
溶液。②准确量取①中溶液
 于烧杯中,加入足量的盐酸酸化的
于烧杯中,加入足量的盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体 。
。③准确量取①中溶液
 于烧杯中,加入足量的
于烧杯中,加入足量的 溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体
溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体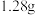 。
。该聚合硫酸铁组成中
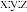 为
为A. | B. | C.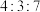 | D. |
您最近一年使用:0次
2023-12-30更新
|
165次组卷
|
3卷引用:选择题11-14



