名校
1 . 三个密闭容器分别装有A.Na2O2和NaHCO3, B.Na2O2和NH4HCO3, C.Na2O2和Ca(HCO3)2,其中每种物质均为1mol。将它们加热至300℃,充分反应后排出气体。
(1)写出各容器中残余物质的化学式及物质的量。
A._____ ; B._____ ; C._____ 。
(2)如果分别加入相同浓度的足量盐酸与残留物完全反应,则消耗盐酸的体积由大到小的顺序是_____ 。
(3)如果分别将A、B、C中原物质加入水中完全反应后溶质分别是什么?现象如何?
A:_____ ; B:_____ ; C:_____ 。
(1)写出各容器中残余物质的化学式及物质的量。
A.
(2)如果分别加入相同浓度的足量盐酸与残留物完全反应,则消耗盐酸的体积由大到小的顺序是
(3)如果分别将A、B、C中原物质加入水中完全反应后溶质分别是什么?现象如何?
A:
您最近一年使用:0次
解题方法
2 . 过氧化钙水合物( ,x>2)微溶于水,能溶于酸,
,x>2)微溶于水,能溶于酸, 性质与
性质与 相似,可用作医用防腐剂和消毒剂。实验室制备过氧化钙的流程如下:
相似,可用作医用防腐剂和消毒剂。实验室制备过氧化钙的流程如下:

回答下列问题:
(1)步骤Ⅰ中应过量的试剂为______ (填“稀盐酸”或“碳酸钙”)。
(2)步骤Ⅱ中发生反应的离子方程式为___________ 。
(3)步骤Ⅴ烘干的同时计算确定水合物中x的值。从下列仪器中选出步骤Ⅴ中所需仪器为______ (填标号)。

过程中需至少称量_____ 次;当_____ 时可认为烘干完全。
(4)利用如图装置(夹持装置省略)测定产品中 的纯度。常温常压下,称取mg产品,记录量气管起始读数为5.00mL,从分液漏斗中迅速加入15.00mL的盐酸(足量)后,立即关闭旋塞。恢复至室温后,调整量气管读数为40.00mL。
的纯度。常温常压下,称取mg产品,记录量气管起始读数为5.00mL,从分液漏斗中迅速加入15.00mL的盐酸(足量)后,立即关闭旋塞。恢复至室温后,调整量气管读数为40.00mL。

仪器A的名称是_______ ;室温下气体摩尔体积为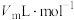 ,该产品的纯度为
,该产品的纯度为______ %(用含m、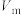 的代数式表示);若读数时,未调平水准管与量气管的液面,所测定产品的纯度会
的代数式表示);若读数时,未调平水准管与量气管的液面,所测定产品的纯度会______ (填“偏高”“偏低”或“无影响”)。
 ,x>2)微溶于水,能溶于酸,
,x>2)微溶于水,能溶于酸, 性质与
性质与 相似,可用作医用防腐剂和消毒剂。实验室制备过氧化钙的流程如下:
相似,可用作医用防腐剂和消毒剂。实验室制备过氧化钙的流程如下:
回答下列问题:
(1)步骤Ⅰ中应过量的试剂为
(2)步骤Ⅱ中发生反应的离子方程式为
(3)步骤Ⅴ烘干的同时计算确定水合物中x的值。从下列仪器中选出步骤Ⅴ中所需仪器为

过程中需至少称量
(4)利用如图装置(夹持装置省略)测定产品中
 的纯度。常温常压下,称取mg产品,记录量气管起始读数为5.00mL,从分液漏斗中迅速加入15.00mL的盐酸(足量)后,立即关闭旋塞。恢复至室温后,调整量气管读数为40.00mL。
的纯度。常温常压下,称取mg产品,记录量气管起始读数为5.00mL,从分液漏斗中迅速加入15.00mL的盐酸(足量)后,立即关闭旋塞。恢复至室温后,调整量气管读数为40.00mL。
仪器A的名称是
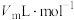 ,该产品的纯度为
,该产品的纯度为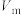 的代数式表示);若读数时,未调平水准管与量气管的液面,所测定产品的纯度会
的代数式表示);若读数时,未调平水准管与量气管的液面,所测定产品的纯度会
您最近一年使用:0次
名校
解题方法
3 . 现有处于不同主族的短周期元素A、B、C、D、E,其中B原子最外层电子数是电子层数的2倍,C是金属元素, 的D的最高价氧化物的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
的D的最高价氧化物的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列推断正确的是

 的D的最高价氧化物的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
的D的最高价氧化物的水化物溶液pH<1,五种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
| A.除A外,均属于P区元素 |
| B.B、D、E形成的简单氢化物均为极性分子 |
| C.B分别与D、E形成的分子中,后者键角更大 |
| D.五种元素形成的单质中,熔点最高的是B的单质 |
您最近一年使用:0次
解题方法
4 . 下列实验操作对应的实验现象错误的是
| 选项 | 实验操作 | 实验现象 |
| A | 向KI溶液中滴加淀粉溶液 | 溶液变蓝 |
| B | 向 溶液中滴加NaOH溶液 溶液中滴加NaOH溶液 | 白色沉淀→灰绿色沉淀→红褐色沉淀 |
| C | 向饱和 溶液中加入少量纯碱粉末 溶液中加入少量纯碱粉末 | 生成白色沉淀 |
| D | 向酸性 溶液中加入过量甲苯,振荡 溶液中加入过量甲苯,振荡 |  溶液的紫红色消失 溶液的紫红色消失 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-14更新
|
221次组卷
|
3卷引用:海南省2022-2023学年高三上学期期末学业水平诊断化学试题
解题方法
5 . 红矶钠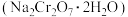 是重要的化工原料,工业上以铬铁矿(
是重要的化工原料,工业上以铬铁矿( ,含少量
,含少量 、
、 )为主要原料制备红矾钠的工艺流程如下:
)为主要原料制备红矾钠的工艺流程如下:

已知:i. ii.
ii.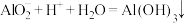
回答下列问题:
(1)焙烧铬铁矿生成 ,并将
,并将 和
和 转化为可溶性钠盐。
转化为可溶性钠盐。
①焙烧时为加快反应速率,可采取的措施是_______ 。
②生成 的化学方程式如下,将其补充完整:
的化学方程式如下,将其补充完整:_______ 。
□ +□
+□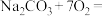 □______+□
□______+□ +□
+□
(2)滤液2中含有的溶质有: 、
、_______ 。
(3)中和时 的理论范围为4.5~9.3,调控
的理论范围为4.5~9.3,调控 不过高也不能过低的理由
不过高也不能过低的理由_______ 。
(4)酸化后所得溶液中主要含有 和
和 。
。

①结晶时,将混合溶液加热浓缩、_______ (填操作)、冷却结晶、过滤得到红矾钠晶体。
②滤液5最适宜返回上述流程_______ 中,参与循环再利用。
(5)工业上还可用膜电解技术(装置如图所示),以 为主要原料制备
为主要原料制备 ,结合化学用语简述制备
,结合化学用语简述制备 的原理:
的原理:_______ 。

(6) 可用于测定水体的COD(COD是指每升水样中还原性物质被氧化所需要
可用于测定水体的COD(COD是指每升水样中还原性物质被氧化所需要 的质量)。现有某水样
的质量)。现有某水样 ,酸化后加入
,酸化后加入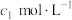 的
的 溶液
溶液 ,使水样中的还原性物质完全被氧化;再用
,使水样中的还原性物质完全被氧化;再用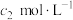 的
的 溶液滴定剩余的
溶液滴定剩余的 ,消耗
,消耗 溶液
溶液 ,则该水样的
,则该水样的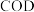 为
为_______  。【
。【 被还原为
被还原为 ;换算关系:
;换算关系: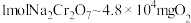 】
】
 是重要的化工原料,工业上以铬铁矿(
是重要的化工原料,工业上以铬铁矿( ,含少量
,含少量 、
、 )为主要原料制备红矾钠的工艺流程如下:
)为主要原料制备红矾钠的工艺流程如下:
已知:i.
 ii.
ii.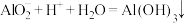
回答下列问题:
(1)焙烧铬铁矿生成
 ,并将
,并将 和
和 转化为可溶性钠盐。
转化为可溶性钠盐。①焙烧时为加快反应速率,可采取的措施是
②生成
 的化学方程式如下,将其补充完整:
的化学方程式如下,将其补充完整:□
 +□
+□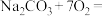 □______+□
□______+□ +□
+□
(2)滤液2中含有的溶质有:
 、
、(3)中和时
 的理论范围为4.5~9.3,调控
的理论范围为4.5~9.3,调控 不过高也不能过低的理由
不过高也不能过低的理由(4)酸化后所得溶液中主要含有
 和
和 。
。
①结晶时,将混合溶液加热浓缩、
②滤液5最适宜返回上述流程
(5)工业上还可用膜电解技术(装置如图所示),以
 为主要原料制备
为主要原料制备 ,结合化学用语简述制备
,结合化学用语简述制备 的原理:
的原理:
(6)
 可用于测定水体的COD(COD是指每升水样中还原性物质被氧化所需要
可用于测定水体的COD(COD是指每升水样中还原性物质被氧化所需要 的质量)。现有某水样
的质量)。现有某水样 ,酸化后加入
,酸化后加入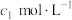 的
的 溶液
溶液 ,使水样中的还原性物质完全被氧化;再用
,使水样中的还原性物质完全被氧化;再用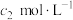 的
的 溶液滴定剩余的
溶液滴定剩余的 ,消耗
,消耗 溶液
溶液 ,则该水样的
,则该水样的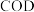 为
为 。【
。【 被还原为
被还原为 ;换算关系:
;换算关系: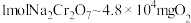 】
】
您最近一年使用:0次
名校
解题方法
6 . 实验室中有一白色粉末样品,可能含NaCl、KBr、 、
、 、
、 中的一种或多种。取少量样品进行如下实验:
中的一种或多种。取少量样品进行如下实验:
①溶解于水,得澄清蓝色溶液,取上层清液,做焰色试验,火焰为黄色;
②向①的溶液中加入适量铁粉,离心分离,溶液底部有紫红色粉末,溶液久置后出现红褐色沉淀;
③取②的上层清液,通入 ,加入1mL
,加入1mL ,振荡,有层为橙红色。
,振荡,有层为橙红色。
下列有关判断正确的是
 、
、 、
、 中的一种或多种。取少量样品进行如下实验:
中的一种或多种。取少量样品进行如下实验:①溶解于水,得澄清蓝色溶液,取上层清液,做焰色试验,火焰为黄色;
②向①的溶液中加入适量铁粉,离心分离,溶液底部有紫红色粉末,溶液久置后出现红褐色沉淀;
③取②的上层清液,通入
 ,加入1mL
,加入1mL ,振荡,有层为橙红色。
,振荡,有层为橙红色。下列有关判断正确的是
| A.上述实验中涉及两个氧化还原反应 |
B.样品中一定不含 ,不能确定是否含 ,不能确定是否含 |
C.样品中一定含NaCl、KBr、 |
| D.实验③的橙红色是氯单质或溴单质在有机层中的颜色 |
您最近一年使用:0次
2022-12-23更新
|
457次组卷
|
4卷引用: 河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试化学试题
河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试化学试题 (已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(9-16)辽宁省沈阳市第二中学2022-2023学年高三上学期期末考试化学试题 河南省郑州市等3地2022-2023学年高三上学期12月月考化学试题
7 . 某新型纳米材料氧缺位铁酸盐ZnFe2Ox(3<x<4),能在常温下将工业废气中的SO2、NO2等转化为单质而除去,由锌灰(含ZnO和少量PbO、CuO、Fe2O3等)为主要原料制备氧缺位铁酸盐及其转化废气的流程如图所示,下列说法不正确 的是
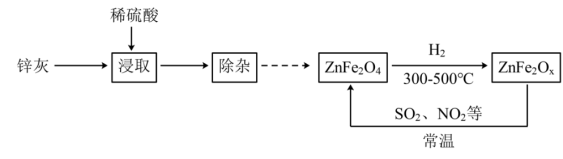

| A.浸取时为了提高酸浸效率,可以搅拌或延长浸取时间 |
| B.“除杂”过程中需要加入足量锌粉等操作,与锌粉反应的金属离子有Fe3+、Cu2+ |
| C.除去SO2时,ZnFe2Ox在反应中表现出氧化性 |
| D.ZnFe2O4与H2反应制得1molZnFe2Ox时,转移的电子物质的量为(8-2x)mol |
您最近一年使用:0次
2022-05-14更新
|
1315次组卷
|
6卷引用:江苏省连云港市2021-2022学年高三高考考前模拟考试(一)化学试题
江苏省连云港市2021-2022学年高三高考考前模拟考试(一)化学试题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)选择题6-10江苏省扬州市宝应县2023-2024学年高三上学期期末模拟化学试卷江苏省徐州市2021-2022学年高一下学期期末抽测化学试题
8 . 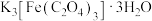 为溶于水而难溶于乙醇的翠绿色晶体,可用于制备负载型活性铁催化剂。实验室以
为溶于水而难溶于乙醇的翠绿色晶体,可用于制备负载型活性铁催化剂。实验室以 为原料制备
为原料制备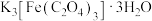 的流程如下:
的流程如下:

已知:① 为淡黄色晶体,难溶于水而溶于稀
为淡黄色晶体,难溶于水而溶于稀 ,真空下142℃开始失去结晶水。
,真空下142℃开始失去结晶水。
②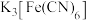 溶液与
溶液与 反应产生蓝色沉淀,与
反应产生蓝色沉淀,与 不反应。
不反应。
(1)氧化配位。将 加入到过量饱和
加入到过量饱和 溶液中,保持温度40℃缓缓加入
溶液中,保持温度40℃缓缓加入 ,获得含配离子
,获得含配离子 和
和 的悬浊液。
的悬浊液。
①检验悬浊液中Fe(Ⅱ)已被完全氧化的实验方法为___________ 。
②反应结束后,需要将悬浊液煮沸30s,其目的是___________ 。
(2)酸溶配位。加入饱和 溶液所发生反应的化学方程式为
溶液所发生反应的化学方程式为___________ 。从溶液中获得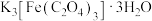 ,除了蒸发浓缩、降温结晶,还可选择的方法为
,除了蒸发浓缩、降温结晶,还可选择的方法为___________ 。
(3)某研究性学习小组拟用已提纯的 溶液为原料制备高纯
溶液为原料制备高纯 。
。
已知: 、
、 的溶解度曲线如图所示;100℃时生成
的溶解度曲线如图所示;100℃时生成 大颗粒便于过滤。
大颗粒便于过滤。

请完成实验方案:取一定体积 溶液置于锥形瓶中,在搅拌下加入等体积相同浓度的
溶液置于锥形瓶中,在搅拌下加入等体积相同浓度的___________ ,得到 。(可选用的试剂:
。(可选用的试剂: 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、稀盐酸、蒸馏水。)
溶液、稀盐酸、蒸馏水。)
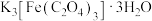 为溶于水而难溶于乙醇的翠绿色晶体,可用于制备负载型活性铁催化剂。实验室以
为溶于水而难溶于乙醇的翠绿色晶体,可用于制备负载型活性铁催化剂。实验室以 为原料制备
为原料制备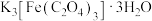 的流程如下:
的流程如下:
已知:①
 为淡黄色晶体,难溶于水而溶于稀
为淡黄色晶体,难溶于水而溶于稀 ,真空下142℃开始失去结晶水。
,真空下142℃开始失去结晶水。②
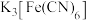 溶液与
溶液与 反应产生蓝色沉淀,与
反应产生蓝色沉淀,与 不反应。
不反应。(1)氧化配位。将
 加入到过量饱和
加入到过量饱和 溶液中,保持温度40℃缓缓加入
溶液中,保持温度40℃缓缓加入 ,获得含配离子
,获得含配离子 和
和 的悬浊液。
的悬浊液。①检验悬浊液中Fe(Ⅱ)已被完全氧化的实验方法为
②反应结束后,需要将悬浊液煮沸30s,其目的是
(2)酸溶配位。加入饱和
 溶液所发生反应的化学方程式为
溶液所发生反应的化学方程式为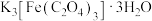 ,除了蒸发浓缩、降温结晶,还可选择的方法为
,除了蒸发浓缩、降温结晶,还可选择的方法为(3)某研究性学习小组拟用已提纯的
 溶液为原料制备高纯
溶液为原料制备高纯 。
。已知:
 、
、 的溶解度曲线如图所示;100℃时生成
的溶解度曲线如图所示;100℃时生成 大颗粒便于过滤。
大颗粒便于过滤。
请完成实验方案:取一定体积
 溶液置于锥形瓶中,在搅拌下加入等体积相同浓度的
溶液置于锥形瓶中,在搅拌下加入等体积相同浓度的 。(可选用的试剂:
。(可选用的试剂: 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、稀盐酸、蒸馏水。)
溶液、稀盐酸、蒸馏水。)
您最近一年使用:0次
9 . NA为阿伏加德罗常数的值。下列叙述正确的是
| A.铜与浓硝酸反应生成22.4L气体时转移电子数为NA |
| B.标准状况下,22.4LHF含有的质子数为10 NA |
| C.6g SiO2晶体中含的硅氧键的数目为0.2 NA |
| D.100g 质量分数为46%的乙醇水溶液中,氧原子的数目为4 NA |
您最近一年使用:0次
名校
10 . 通过下列实验可以从废铜屑中制取CuSO4·5H2O。

下列说法正确的是
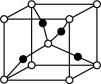

下列说法正确的是

| A.加入Na2CO3溶液的作用是除去废铜屑表面的油污 |
| B.“氧化”时反应的离子方程式:Cu+H2O2+2H+=Cu2++H2O |
| C.操作1是蒸发浓缩、冷却结晶 |
| D.将CuSO4·5H2O加热到1000℃以上会分解得到Cu2O,1个Cu2O晶胞(如图)中含1个氧原子 |
您最近一年使用:0次
2022-01-20更新
|
508次组卷
|
5卷引用:江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题
江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第9题 化学工艺流程选择题 -备战2022年高考化学临考题号押题(江苏卷)湖南省郴州市第二中学2022届高三下学期期中考试化学试题江苏省泰州中学2021-2022学年高二下学期第一次质量检测化学试题



