名校
解题方法
1 . 制备某无机化合物的转化流程如图所示,下列说法错误的是


A.该转化流程中 均被循环使用,是催化剂 均被循环使用,是催化剂 |
| B.该循环过程中未涉及氧化还原反应 |
C.存在反应 |
| D.该工艺是利用食盐和石灰石制取纯碱 |
您最近一年使用:0次
2024-01-07更新
|
97次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期期中考试卷(化学)
2 . 无水 常用作有机合成的脱水剂、缩合剂和催化剂。无水
常用作有机合成的脱水剂、缩合剂和催化剂。无水 易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水
易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水 ,并测定其纯度,实验装置如图所示:
,并测定其纯度,实验装置如图所示:
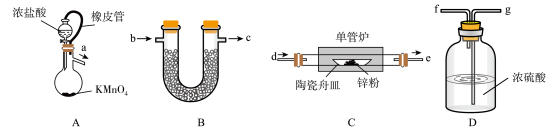
(1)装置A中反应的离子方程式为___________ ;装置A中橡皮管的作用为___________ 。
(2)按气流从左到右的方向,装置合理的连接顺序为___________
 (填接口小写字母)。
(填接口小写字母)。
(3)若省略装置D,经检验产物中含有氧化锌,利用所学知识解释原因___________ 。
(4)装置B中药品的作用为___________ 。
(5)氯化锌纯度的测定:将ag试样配成 溶液。取
溶液。取 ,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用
,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用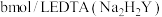 标准溶液滴定
标准溶液滴定 ,反应的离子方程式为
,反应的离子方程式为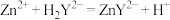 ,达到终点时,消耗EDTA溶液的平均体积为
,达到终点时,消耗EDTA溶液的平均体积为 。
。
①配制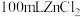 溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、___________ 。
②该氯化锌试样中氯化锌的质量分数为___________ (用含a.b的代数式表示)。
 常用作有机合成的脱水剂、缩合剂和催化剂。无水
常用作有机合成的脱水剂、缩合剂和催化剂。无水 易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水
易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水 ,并测定其纯度,实验装置如图所示:
,并测定其纯度,实验装置如图所示:
(1)装置A中反应的离子方程式为
(2)按气流从左到右的方向,装置合理的连接顺序为
 (填接口小写字母)。
(填接口小写字母)。(3)若省略装置D,经检验产物中含有氧化锌,利用所学知识解释原因
(4)装置B中药品的作用为
(5)氯化锌纯度的测定:将ag试样配成
 溶液。取
溶液。取 ,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用
,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用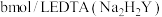 标准溶液滴定
标准溶液滴定 ,反应的离子方程式为
,反应的离子方程式为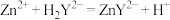 ,达到终点时,消耗EDTA溶液的平均体积为
,达到终点时,消耗EDTA溶液的平均体积为 。
。①配制
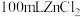 溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、②该氯化锌试样中氯化锌的质量分数为
您最近一年使用:0次
名校
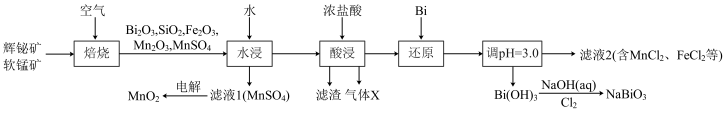
3 . 铋酸钠(NaBiO3)是常用的氧化剂,MnO2是活性电极。以辉铋矿(主要成分为Bi2S3,含FeS2、SiO2杂质)和软锰矿(主要成分是MnO2)为原料联合焙烧制备NaBiO3和MnO2,流程如下:
已知:①金属活动性:Fe>(H)>Bi>Cu。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1)NaBiO3中Bi的化合价为_____ 。气体X是_____ (填化学式)。
(2)“焙烧”中Bi2S3和MnO2与空气反应生成Bi2O3和MnSO4,写出其反应的化学方程式:_____ 。被还原的元素是_____ (填元素符号)。
(3)“还原”中Bi的作用是_____ 。
(4)检验滤液2中是否有FeCl3的试剂是_____ (填化学式)。
(5)已知Bi(OH)3难溶于水,NaBiO3难溶于冷水,写出冷水中利用Bi(OH)3制备NaBiO3的离子方程式:_____ 。
(6)为探究Cl2和NaBiO3的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:NaBiO3_____ Cl2(填“>”或“<”)。与根据第(5)小题得出的NaBiO3与Cl2氧化性强弱关系相反,其主要原因是_____ 。

已知:①金属活动性:Fe>(H)>Bi>Cu。
②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 2.8 |
| Fe2+ | 6.3 | 8.3 |
| Mn2+ | 8.1 | 10.1 |
(1)NaBiO3中Bi的化合价为
(2)“焙烧”中Bi2S3和MnO2与空气反应生成Bi2O3和MnSO4,写出其反应的化学方程式:
(3)“还原”中Bi的作用是
(4)检验滤液2中是否有FeCl3的试剂是
(5)已知Bi(OH)3难溶于水,NaBiO3难溶于冷水,写出冷水中利用Bi(OH)3制备NaBiO3的离子方程式:
(6)为探究Cl2和NaBiO3的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:NaBiO3
您最近一年使用:0次
名校
4 . 已知反应: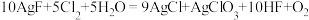 。下列关于该反应的叙述不正确的是
。下列关于该反应的叙述不正确的是
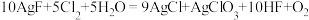 。下列关于该反应的叙述不正确的是
。下列关于该反应的叙述不正确的是| A.该反应中,氧化剂与还原剂的物质的量之比为9:5 |
| B.每产生1mol O2时,被氧元素还原的氯气物质的量为2mol |
| C.当反应中有1mol电子转移时,被还原氯气物质的量为1mol |
D.参加反应的水有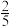 被氧化 被氧化 |
您最近一年使用:0次
2023-12-23更新
|
208次组卷
|
2卷引用:黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高三上学期期中考试化学试题
解题方法
5 . 高铁酸盐 是优良的多功能水处理剂。
是优良的多功能水处理剂。 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在
溶液,难溶于有机物;在 、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 某实验小组制备高铁酸钾并测定产品纯度。回答下列问题:
某实验小组制备高铁酸钾并测定产品纯度。回答下列问题:
制备 (装置如图所示,夹持、加热等装置略)
(装置如图所示,夹持、加热等装置略)
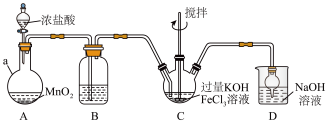
(1)仪器 的名称是
的名称是______ ,装置B中除杂质所用试剂是______ 。
(2)C中发生反应的离子方程式为______ 。
(3) 中反应为放热反应,而反应温度须控制在0∼5℃,采用的控温方法为,
中反应为放热反应,而反应温度须控制在0∼5℃,采用的控温方法为,______ ,反应中 必须过量的原因是
必须过量的原因是______ 。
(4)D中反应可制备漂白液,反应的离子方程式为______ 。
(5) 中由
中由 制备
制备 ,若生成
,若生成 ,则该反应过程中转移的电子数目
,则该反应过程中转移的电子数目______ 。
 是优良的多功能水处理剂。
是优良的多功能水处理剂。 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在
溶液,难溶于有机物;在 、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 某实验小组制备高铁酸钾并测定产品纯度。回答下列问题:
某实验小组制备高铁酸钾并测定产品纯度。回答下列问题:制备
 (装置如图所示,夹持、加热等装置略)
(装置如图所示,夹持、加热等装置略)
(1)仪器
 的名称是
的名称是(2)C中发生反应的离子方程式为
(3)
 中反应为放热反应,而反应温度须控制在0∼5℃,采用的控温方法为,
中反应为放热反应,而反应温度须控制在0∼5℃,采用的控温方法为, 必须过量的原因是
必须过量的原因是(4)D中反应可制备漂白液,反应的离子方程式为
(5)
 中由
中由 制备
制备 ,若生成
,若生成 ,则该反应过程中转移的电子数目
,则该反应过程中转移的电子数目
您最近一年使用:0次
名校
6 . 某实验小组欲探究 和
和 的性质,发现实验室里盛放两种固体的试剂瓶丢了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
的性质,发现实验室里盛放两种固体的试剂瓶丢了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为___________ 。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现 固体完全溶解,而
固体完全溶解,而 固体有剩余,由此得出结论:
固体有剩余,由此得出结论:___________ 。
②同学们在两烧杯中还观察到以下现象。其中,盛放 的烧杯中出现的现象是
的烧杯中出现的现象是___________ (填字母序号)
a.溶液温度升高 b.溶液温度下降
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。
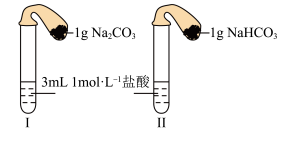
①两试管中均产生气体,___________ 的反应程度更为剧烈。(填“I”或“II”)
②反应结束后,恢复至室温,下列说法正确的是___________ 。
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成 的溶液,设计如下方案并对反应现象做出预测:
的溶液,设计如下方案并对反应现象做出预测:
实施实验后,发现操作1的现象与预测有差异:产生白色沉淀和二氧化碳气体。则该条件下, 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
 和
和 的性质,发现实验室里盛放两种固体的试剂瓶丢了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
的性质,发现实验室里盛放两种固体的试剂瓶丢了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现
 固体完全溶解,而
固体完全溶解,而 固体有剩余,由此得出结论:
固体有剩余,由此得出结论:②同学们在两烧杯中还观察到以下现象。其中,盛放
 的烧杯中出现的现象是
的烧杯中出现的现象是a.溶液温度升高 b.溶液温度下降
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,
②反应结束后,恢复至室温,下列说法正确的是
a.装置I的气球体积较大 b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成
 的溶液,设计如下方案并对反应现象做出预测:
的溶液,设计如下方案并对反应现象做出预测:| 实验方案 | 预测现象 | 预测依据 |
操作1:向 溶液中滴加 溶液中滴加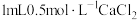 溶液 溶液 | 无白色沉淀 |  溶液中的 溶液中的 浓度很小,不能与 浓度很小,不能与 反应 反应 |
操作2:向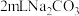 溶液中滴加 溶液中滴加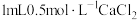 溶液 溶液 | 有白色沉淀 |  溶液中的 溶液中的 浓度较大,能与 浓度较大,能与 发生反应 发生反应 |
 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
名校
7 . 完成下列问题。
(1) 为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。

①A中发生反应的离子反应方程式是___________ 。
②下列试剂中,装置B的X溶液可以选用的是___________ 。
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D. 溶液
溶液
③C中得到紫色固体和溶液,生成 的化学方程式是
的化学方程式是___________ ;若要从反应后的装置C中尽可能得到更多的 固体,可以采取的一种措施是
固体,可以采取的一种措施是___________ 。
(2)高铁酸钾与水反应的离子方程式是 。则其作为水处理剂的原理是①
。则其作为水处理剂的原理是①___________ ,②___________ 。
(3)某同学设计如图装置制备一定量的 ,并使其能在较长时间内存在。
,并使其能在较长时间内存在。

①X不能是硝酸,原因是___________ ,装置4的作用是___________ 。
②实验开始时,开关 应
应___________ (填“打开”成“关闭”);这样操作的目的是___________ 。
(1)
 为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。
①A中发生反应的离子反应方程式是
②下列试剂中,装置B的X溶液可以选用的是
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D.
 溶液
溶液③C中得到紫色固体和溶液,生成
 的化学方程式是
的化学方程式是 固体,可以采取的一种措施是
固体,可以采取的一种措施是(2)高铁酸钾与水反应的离子方程式是
 。则其作为水处理剂的原理是①
。则其作为水处理剂的原理是①(3)某同学设计如图装置制备一定量的
 ,并使其能在较长时间内存在。
,并使其能在较长时间内存在。
①X不能是硝酸,原因是
②实验开始时,开关
 应
应
您最近一年使用:0次
解题方法
8 . Na及其化合物具有独特的性质和重要的用途。
(1)钠着火时应采取的灭火措施是___________ ,不能用水灭火; 常用于呼吸面具中,有关反应的化学方程式为
常用于呼吸面具中,有关反应的化学方程式为___________ (任写一个即可)。
(2)用洁净的铂丝蘸取 溶液置于酒精灯火焰上灼烧,火焰呈
溶液置于酒精灯火焰上灼烧,火焰呈___________ 色。
(3) 常用于焙制糕点,其原理为
常用于焙制糕点,其原理为___________ 。
(4)向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的 ,充分反应后,得到含
,充分反应后,得到含 和
和 的混合溶液,向上述所得溶液中,逐滴滴加2
的混合溶液,向上述所得溶液中,逐滴滴加2 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
的盐酸,所得气体的体积与所加盐酸的体积关系如图所示。

①OA段、AB段发生反应的离子方程式为___________ 、___________ 。
②B点时,反应后所得溶液中溶质的物质的量浓度是___________  。
。
③混合溶液中 和
和 的质量之比是
的质量之比是___________ 。
(1)钠着火时应采取的灭火措施是
 常用于呼吸面具中,有关反应的化学方程式为
常用于呼吸面具中,有关反应的化学方程式为(2)用洁净的铂丝蘸取
 溶液置于酒精灯火焰上灼烧,火焰呈
溶液置于酒精灯火焰上灼烧,火焰呈(3)
 常用于焙制糕点,其原理为
常用于焙制糕点,其原理为(4)向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的
 ,充分反应后,得到含
,充分反应后,得到含 和
和 的混合溶液,向上述所得溶液中,逐滴滴加2
的混合溶液,向上述所得溶液中,逐滴滴加2 的盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
的盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
①OA段、AB段发生反应的离子方程式为
②B点时,反应后所得溶液中溶质的物质的量浓度是
 。
。③混合溶液中
 和
和 的质量之比是
的质量之比是
您最近一年使用:0次
2023-11-10更新
|
373次组卷
|
3卷引用:江西省宜春市百树学校2023-2024学年高三上学期11月期中考试化学试卷
名校
解题方法
9 . 某小组同学探究FeSO4溶液与NaClO溶液的反应。
实验Ⅰ:向敞口容器中加入一定体积0.1mol·L-1FeSO4溶液,不断搅拌,逐滴加入pH≈13的84消毒液,溶液pH变化曲线如下图所示(从B点开始滴入84消毒液)。

B~C段,开始时产生红褐色沉淀,随后沉淀消失,溶液变为暗红色;
C点之后,逐渐产生大量黄色沉淀,有刺激性气味气体产生,溶液颜色明显变浅。
已知:25℃,饱和NaClO溶液的pH约为11,Fe3+完全沉淀时的pH≈13。
(1)Cl2通入NaOH溶液可得上述84消毒液,该84消毒液中阴离子主要有___________ 。
(2)A~B段,FeSO4溶液在搅拌下pH略有下降,用离子方程式解释原因___________ 。
(3)B~C段,产生红褐色沉淀的离子方程式为___________ 。查阅资料可知,暗红色物质为聚合硫酸铁,是一种无机高分子化合物,其主要阳离子的结构为如下所示,该阳离子中Fe的配位数为___________ 。
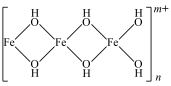
(4)取少量C点溶液,加入___________ (补充试剂和现象),证明溶液中无Fe2+。C点之后产生的黄色沉淀经检验为铁黄(FeOOH),写出暗红色物质转化为黄色沉淀的离子方程式___________ 。
实验Ⅱ:向敞口容器中加入一定体积的pH≈13的84消毒液,不断搅拌,逐滴加入0.1mol·L-1FeSO4溶液,溶液pH变化曲线如下图所示。

E→H段,迅速产生大量红褐色沉淀且逐渐增多,H后开始产生有刺激性气味的气体,最终得到暗红色溶液和大量黄色沉淀。
已知:Cl2、HClO、ClO-在不同pH条件下的百分含量如下图:

(5)G→H段pH骤降的原因是___________ (用离子方程式表示)。
(6)综合以上实验,FeSO4溶液与NaClO溶液的反应产物与___________ 有关。
实验Ⅰ:向敞口容器中加入一定体积0.1mol·L-1FeSO4溶液,不断搅拌,逐滴加入pH≈13的84消毒液,溶液pH变化曲线如下图所示(从B点开始滴入84消毒液)。

B~C段,开始时产生红褐色沉淀,随后沉淀消失,溶液变为暗红色;
C点之后,逐渐产生大量黄色沉淀,有刺激性气味气体产生,溶液颜色明显变浅。
已知:25℃,饱和NaClO溶液的pH约为11,Fe3+完全沉淀时的pH≈13。
(1)Cl2通入NaOH溶液可得上述84消毒液,该84消毒液中阴离子主要有
(2)A~B段,FeSO4溶液在搅拌下pH略有下降,用离子方程式解释原因
(3)B~C段,产生红褐色沉淀的离子方程式为

(4)取少量C点溶液,加入
实验Ⅱ:向敞口容器中加入一定体积的pH≈13的84消毒液,不断搅拌,逐滴加入0.1mol·L-1FeSO4溶液,溶液pH变化曲线如下图所示。

E→H段,迅速产生大量红褐色沉淀且逐渐增多,H后开始产生有刺激性气味的气体,最终得到暗红色溶液和大量黄色沉淀。

已知:Cl2、HClO、ClO-在不同pH条件下的百分含量如下图:

(5)G→H段pH骤降的原因是
(6)综合以上实验,FeSO4溶液与NaClO溶液的反应产物与
您最近一年使用:0次
2023-11-06更新
|
218次组卷
|
3卷引用:北京市丰台区2023-2024学年高三上学期期中练习化学试题
解题方法
10 . I.由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:
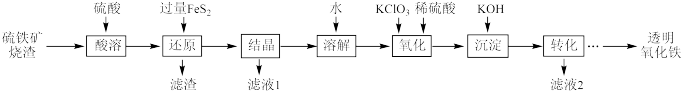
已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为___________ 。
(2)“滤渣”中的主要成分是___________ 。
(3)“还原”过程中涉及的离子方程式为___________ 。
(4)流程中“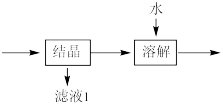 ”环节的目的是
”环节的目的是___________ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以___________ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:
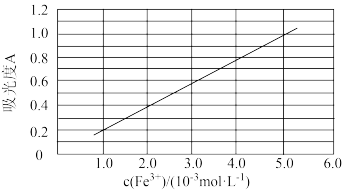
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为___________ %(保留小数点后一位)。
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:
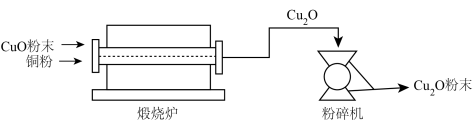
(7)粉碎机中,发生的变化属于___________ (填“物理变化”或“化学变化”)。
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为___________ 。

已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为
(2)“滤渣”中的主要成分是
(3)“还原”过程中涉及的离子方程式为
(4)流程中“
 ”环节的目的是
”环节的目的是(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:

(7)粉碎机中,发生的变化属于
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为
您最近一年使用:0次



