1 . 草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水可溶于稀硫酸的固体,具有较强还原性,受热易分解,是生产电池、涂料以及感光材料的原材料。某化学活动小组分别设计了相应装置进行草酸亚铁的制备及其性质实验。回答下列问题:
Ⅰ.制备草酸亚铁晶体(装置如图所示):

(1)盛装稀硫酸的仪器名称为_____________________ 。
(2)实验过程:待 中反应一段时间后,需要对开关进行的操作是
中反应一段时间后,需要对开关进行的操作是_________ 。
(3)装置 的作用
的作用 _________________________ 。
Ⅱ.草酸亚铁晶体热分解产物的探究:

(4)装置C和D可以可以合并为一个盛有_________________ 的球形干燥管。
(5)从绿色化学考虑,该套装置存在的明显缺陷是_________________ 。
(6)实验结束后,E中黑色固体变为红色,B、F中澄清石灰水变浑浊,a中无水硫酸变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为__________ 。
Ⅲ. 运用热重分析法推测产物
称取3.60g草酸亚铁晶体加热分解,得到剩余固体质量随温度变化的曲线如图所示:

(7)当剩余固体质量为1.60g时,,剩余固体物质的化学式为__________ 。
Ⅰ.制备草酸亚铁晶体(装置如图所示):

(1)盛装稀硫酸的仪器名称为
(2)实验过程:待
 中反应一段时间后,需要对开关进行的操作是
中反应一段时间后,需要对开关进行的操作是(3)装置
 的作用
的作用 Ⅱ.草酸亚铁晶体热分解产物的探究:

(4)装置C和D可以可以合并为一个盛有
(5)从绿色化学考虑,该套装置存在的明显缺陷是
(6)实验结束后,E中黑色固体变为红色,B、F中澄清石灰水变浑浊,a中无水硫酸变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为
Ⅲ. 运用热重分析法推测产物
称取3.60g草酸亚铁晶体加热分解,得到剩余固体质量随温度变化的曲线如图所示:

(7)当剩余固体质量为1.60g时,,剩余固体物质的化学式为
您最近一年使用:0次
解题方法
2 . 能正确表达下列反应的离子方程式为
| A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
B.H2C2O4溶液与酸性高锰酸钾溶液混合:2MnO +5C2O +5C2O +16H+=2Mn2++10CO2↑+8H2O +16H+=2Mn2++10CO2↑+8H2O |
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO =Al2(CO3)3↓ =Al2(CO3)3↓ |
D.用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=NO +NO +NO +H2O +H2O |
您最近一年使用:0次
解题方法
3 . 一种测定黄铁矿(主要成分为FeS2,杂质不含硫)中硫含量的实验原理及步骤如下:

已知:I.2FeS2+15Na2O2 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;
II.Pb2++ =PbSO4↓;
=PbSO4↓;
III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为_______ mol。
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为_______ 。
(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是_______ 。
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为_______ (填字母)。
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为_______ (用含c、V的代数式表示)。
③下列情形下会使测得的硫的质量分数偏大的是_______ (填字母)。
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视

已知:I.2FeS2+15Na2O2
 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;II.Pb2++
 =PbSO4↓;
=PbSO4↓;III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3
 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为
③下列情形下会使测得的硫的质量分数偏大的是
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视
您最近一年使用:0次
名校
解题方法
4 . 市政污泥含大量金属(Cu、Zn、Ni、Fe、Ag等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并完全可以作为资源再次为我们所利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾( )的工艺流程如下:
)的工艺流程如下:

已知:除铁时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀,回答下列问题:
(1)为提高“浸出”效率,可采取的措施有_______ 、_______ (写两条)。
(2)根据流程图可知Cu、Zn、Ni的金属性强弱顺序为_______ 。
(3)置换镍时,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含 溶液中同时加入锌粉和
溶液中同时加入锌粉和 得到金属Ni和Sb的混合物,该混合物可表示为
得到金属Ni和Sb的混合物,该混合物可表示为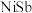 ,形成
,形成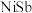 的离子方程式为
的离子方程式为_______ 。
(4)“浸出”的浸渣中含有 ,经一系列处理得
,经一系列处理得 ,用肼(
,用肼( )还原
)还原 得到单质银,
得到单质银, 的氧化产物为
的氧化产物为 ,则还原过程中氧化剂与还原剂的物质的量之比为
,则还原过程中氧化剂与还原剂的物质的量之比为_______ 。
(5)浸出液中含有 ,“除铁”步骤中发生反应的离子方程式为
,“除铁”步骤中发生反应的离子方程式为_______ 。调节pH对不同金属沉出率的影响如下图所示,则沉铁时最合理的pH约为_______ 。

 )的工艺流程如下:
)的工艺流程如下:
已知:除铁时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀,回答下列问题:
(1)为提高“浸出”效率,可采取的措施有
(2)根据流程图可知Cu、Zn、Ni的金属性强弱顺序为
(3)置换镍时,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含
 溶液中同时加入锌粉和
溶液中同时加入锌粉和 得到金属Ni和Sb的混合物,该混合物可表示为
得到金属Ni和Sb的混合物,该混合物可表示为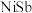 ,形成
,形成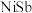 的离子方程式为
的离子方程式为(4)“浸出”的浸渣中含有
 ,经一系列处理得
,经一系列处理得 ,用肼(
,用肼( )还原
)还原 得到单质银,
得到单质银, 的氧化产物为
的氧化产物为 ,则还原过程中氧化剂与还原剂的物质的量之比为
,则还原过程中氧化剂与还原剂的物质的量之比为(5)浸出液中含有
 ,“除铁”步骤中发生反应的离子方程式为
,“除铁”步骤中发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 大多数离子液体含有体积很大的阴、阳离子(如图所示)。其中X、Y、Z为原子序数依次增大的短周期非金属元素,X、Z同主族。下列说法正确的是
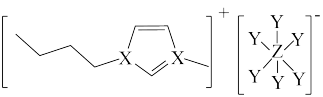

| A.原子半径:Z>X>Y | B.气态氢化物的稳定性:Z>X>Y |
| C.Z的氯化物的分子式一定为ZCl3 | D.此阴离子中Y、Z均满足8电子稳定结构 |
您最近一年使用:0次
2022-07-10更新
|
1346次组卷
|
7卷引用:陕西省咸阳市2022-2023学年高三高考模拟检测(一)化学试题
解题方法
6 . 高铁酸钠( )为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与
)为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与 溶液的反应制备
溶液的反应制备 并探究其性质,实验装置如下图所示。
并探究其性质,实验装置如下图所示。
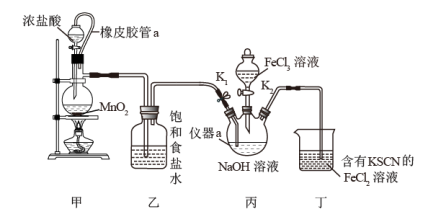
请回答下列问题:
(1)橡皮管a的作用是___________ ,装置甲中反应的化学方程式为___________ 。
(2)若去掉装置乙,其不足之处为___________ 。
(3)当装置丁中出现___________ 现象时,关闭 ;此时向装置丙中加入
;此时向装置丙中加入 溶液。
溶液。
(4)装置丙中生成 的离子方程式为
的离子方程式为___________ 。
(5)反应后,向装置丙中加入饱和的___________ (填化学式)溶液,析出紫色晶体,过滤、洗涤、干燥。
(6)取少量 晶体加入浑浊的泥浆水很快澄清,同时产生气体。请结合化学方程分析
晶体加入浑浊的泥浆水很快澄清,同时产生气体。请结合化学方程分析 的净水原理为
的净水原理为___________ 。
 )为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与
)为紫色固体,易溶于水,微溶于NaOH溶液,具有强氧化性,可以杀菌消毒,是一种新型、高效、多功能的水处理剂。某化学实验小组利用NaClO在碱性介质中与 溶液的反应制备
溶液的反应制备 并探究其性质,实验装置如下图所示。
并探究其性质,实验装置如下图所示。
请回答下列问题:
(1)橡皮管a的作用是
(2)若去掉装置乙,其不足之处为
(3)当装置丁中出现
 ;此时向装置丙中加入
;此时向装置丙中加入 溶液。
溶液。(4)装置丙中生成
 的离子方程式为
的离子方程式为(5)反应后,向装置丙中加入饱和的
(6)取少量
 晶体加入浑浊的泥浆水很快澄清,同时产生气体。请结合化学方程分析
晶体加入浑浊的泥浆水很快澄清,同时产生气体。请结合化学方程分析 的净水原理为
的净水原理为
您最近一年使用:0次
解题方法
7 . 某科研团队研究发现硼氢化钠( )在催化剂Ru表面与水反应可生成
)在催化剂Ru表面与水反应可生成 ,其反应过程如下图所示,下列说法错误的是
,其反应过程如下图所示,下列说法错误的是
BH
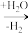 BH3
BH3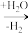 H2B(OH)
H2B(OH)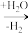 HB(OH)2
HB(OH)2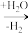 X
X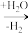 B(OH)
B(OH)
① ② ③ ④ ⑤
 )在催化剂Ru表面与水反应可生成
)在催化剂Ru表面与水反应可生成 ,其反应过程如下图所示,下列说法错误的是
,其反应过程如下图所示,下列说法错误的是BH

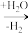 BH3
BH3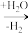 H2B(OH)
H2B(OH)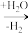 HB(OH)2
HB(OH)2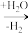 X
X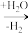 B(OH)
B(OH)
① ② ③ ④ ⑤
A.过程①反应的离子方程式为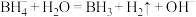 |
B.X是 |
| C.上述反应过程中水均作氧化剂 |
D.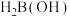 中氢元素的化合价均为+1价 中氢元素的化合价均为+1价 |
您最近一年使用:0次
10-11高二上·甘肃武威·阶段练习
名校
解题方法
8 . 在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量之比为3:2:1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变为1:2:4,则参加反应的铁粉和原溶液中Fe3+的物质的量之比为
| A.2:1 | B.1:2 | C.1:3 | D.1:4 |
您最近一年使用:0次
2021-09-09更新
|
1682次组卷
|
28卷引用:陕西省延安子长市中学2021-2022学年高三上学期期中考试化学试题
陕西省延安子长市中学2021-2022学年高三上学期期中考试化学试题2015届河北省邯郸市高三上学期1月教学质量检测化学试卷2015-2016学年陕西省长安区一中高一上期末化学试卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【押题专练】河北省大名县第一中学2020届高三9月月考化学试题河北省武安市第一中学2020届高三9月月考化学试题甘肃省兰州市第一中学2020届高三9月月考化学试题专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升江西省鹰潭市第一中学2021届高三上学期期中考试化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题(已下线)2010年甘肃省武威五中高二11月月考化学试卷2014-2015江西省新余市高一上学期期末考试化学试卷2014-2015学年辽宁师大附中高二下学期期末考试化学试卷【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题安徽省阜阳市第三中学2018-2019学年高一上学期小期末考试(期末模拟)化学试题宁夏石嘴山市第三中学2019-2020学年高一上学期第二次(12月)月考化学试题安徽省安庆一中2018-2019学年高一上学期期末考试化学试题安徽省太和第一中学2019-2020学年高一上学期期末考试化学试题人教版高中化学必修1第三章《金属及其化合物》测试卷2(已下线)3.1.2 铁的氢氧化物 铁盐和亚铁盐练习(1)——《高中新教材同步备课》(人教版 必修第一册)(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册第三章 铁 金属材料 素养拓展区人教版(2019)高一必修第一册 第三章素养检测重庆市三峡名校联盟2020-2021学年高一上学期12月联考化学试题四川省仁寿第一中学校南校区2020-2021学年高一下学期开学考试化学试题(已下线)8.1 铁及其化合物-2020-2021学年秋季班高二上学期化学教材知识点精讲练(沪科版)(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)广东省普宁市华侨中学2021—2022学年高一上学期第三次月考化学试题
14-15高三上·安徽·阶段练习
名校
解题方法
9 . 向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
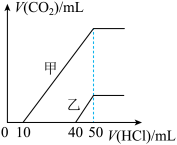

| A.乙溶液中含有的溶质是Na2CO3、NaHCO3 |
| B.当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为OH-+H+ =H2O |
| C.原NaOH溶液的物质的量浓度为0.5mol·L-1 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
您最近一年使用:0次
2021-05-28更新
|
2621次组卷
|
25卷引用:陕西省陕师大附中2018届高三第五次月考化学试题
陕西省陕师大附中2018届高三第五次月考化学试题(已下线)2014届安徽省“江淮十校”协作体高三上学期第一次联考化学试卷2016届山东省威海市乳山市高三上学期期中测试化学试卷2017届河北省涞水县波峰中学高三8月月考化学试卷河南省豫南豫北名校2018届高三精英联赛化学试题1河南省豫南豫北名校2018届高三精英联赛化学试题2【全国百强校】天津市第一中学2019届高三上学期第一次月考化学试题【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题(已下线)2019年1月14日 《每日一题》高考二轮复习-钠及其化合物上海市十二校2015届高三12月联考化学试题天津一中2020届高三第二次月考化学试题福建省福州市第三中学2020-2021学年高三上学期第二次质量检测化学试题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)陕西师范大学附属中学2023-2024学年高一上学期期中考试化学试题2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一上学期第二次月考化学试题河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题广东省广州市三校2021-202学年高一上学期期末联考化学试题四川省南充高级中学2021-2022学年高一下学期开学考试化学试题湖北省荆州市荆州中学2023-2024学年高一上学期期末考试化学试题
10 . 从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.5mol FeS2发生反应,有10mol电子转移 |
C.产物中的SO 离子有一部分是氧化产物 离子有一部分是氧化产物 |
| D.FeS2只作还原剂 |
您最近一年使用:0次
2021-01-12更新
|
1912次组卷
|
41卷引用:2017届陕西省西安市第七十中学高三上学期10月月考化学试卷
2017届陕西省西安市第七十中学高三上学期10月月考化学试卷【全国百强校】陕西省西安市第一中学2019届高三上学期第一次月考化学试题(已下线)2010年安徽省合肥八中高三上学期第二次月考化学试题(已下线)2012届浙江省杭州市高复高三上学期11月份月考化学试卷2016届重庆市巫山中学高三第一次质量检测化学试卷2016届辽宁省葫芦岛市高三上学期期末调研化学试卷2017届河北辛集中学高三上理综测试三化学试卷2017届河北省定州中学高三上期中化学试卷1广东省化州市2018届高三上学期第一次高考模拟考试理综化学试题辽宁省大连育明高级中学、本溪市高级中学2018届高三10月月考化学(理)试题陕西省西安市第一中学2017-2018学年高一上学期期末考试化学试题(已下线)2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 讲【全国百强校】西藏自治区拉萨北京实验中学2019届高三上学期第二次月考化学试题【全国百强校】河北省武邑中学2019届高三上学期第四次调研考试化学试题【全国百强校】山东省临沂市蒙阴县实验中学2019届高三上学期第二次月考(12月)化学试题福建省福州市八县一中2020届高三年上学期期中联考化学试题甘肃省武威第十八中学2021届高三上学期第四次诊断检测(期末)化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)江西省丰城市第九中学2021-2022学年高三上学期9月月考化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)福建省福州市格致中学2022-2023学年高三上学期期中模拟测试化学试题(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷2015-2016学年湖南省长沙长郡中学高一上期末化学试卷2016-2017学年安徽省合肥一中高一上开学测化学试卷2016-2017学年安徽省铜陵一中高一12月月考化学试卷江苏省无锡市普通高中2017-2018学年高一上学期期末考试化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题福建省华安一中、长泰一中等四校2017-2018学年高一下学期第一次(4月)联考化学试题吉林省白城市第一中学2018-2019学年高一上学期12月月考化学试题广东省深圳市实验中学2019-2020学年高一上学期期中考试化学试题安徽省滁州市定远县育才学校2019-2020学年高一(普通班)上学期第三次月考化学试题专题3 第一单元 第3课时 氧化还原反应-高中化学苏教2019版必修第一册山西省山西大学附属中学2022-2023学年高一上学期期中考试化学试题 新疆乌鲁木齐八一中学2023-2024学年高一上学期期中考试化学试卷



