名校
解题方法
1 . 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体在300℃反应制得 和
和 ;
;
③ 与过量
与过量 在1000~1100℃反应制得纯硅。
在1000~1100℃反应制得纯硅。
(1)第②步制备 的化学反应方程式为
的化学反应方程式为_______ 。
(2)整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和另一种物质,写出配平的化学反应方程式
、HCl和另一种物质,写出配平的化学反应方程式_______ 。
Ⅱ.粗硅与氯气反应也可生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
(3)写出装置A中发生反应的离子方程式_______ 。
(4)装置A中g管的作用是_______ ;装置C中的试剂是_______ ;装置E中的h瓶需要冷却的理由是_______ 。
(5)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外还可能含有的杂质元素是_______ (填写元素符号)。
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体在300℃反应制得
 和
和 ;
;③
 与过量
与过量 在1000~1100℃反应制得纯硅。
在1000~1100℃反应制得纯硅。(1)第②步制备
 的化学反应方程式为
的化学反应方程式为(2)整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和另一种物质,写出配平的化学反应方程式
、HCl和另一种物质,写出配平的化学反应方程式Ⅱ.粗硅与氯气反应也可生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |  |  |  |  |  |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | 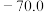 | 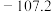 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(4)装置A中g管的作用是
(5)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外还可能含有的杂质元素是
您最近一年使用:0次
名校
解题方法
2 . 固体盐X由四种常见元素组成,其中仅含一种金属元素,有如图转化关系:
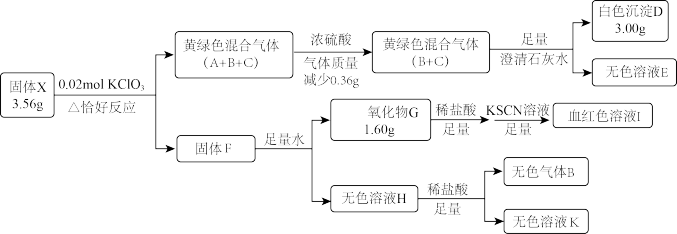
已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为_______ ,固体F成分为_______ 。
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式_______ 。
(3)气体C的化学式为_______ 。将气体C通入KOH溶液,微热,恰好完全反应,生成两种物质的量之比1∶5的盐,写出这两种盐的化学式_______ ,设计定量实验方案验证上述比例关系_______ 。(已知AgClO3溶于水,NaNO2能将ClO3-还原为Cl-)

已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式
(3)气体C的化学式为
您最近一年使用:0次
名校
解题方法
3 . 某同学设计实验探究碳、硅元素的非金属性强弱,实验装置如图所示,已知酸性:H2SO3>H2CO3,回答下列问题:
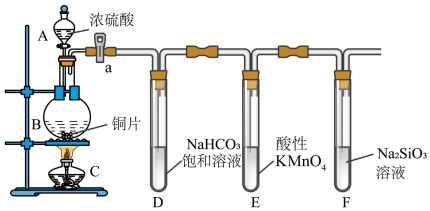
(1)仪器B的名称为_______ 。
(2)实验步骤:①连接仪器,②_______ ,③加入药品,④打开a,滴入浓硫酸,⑤加热观察。
(3)铜与浓硫酸反应的化学方程式为_______ ,装置E中酸性高锰酸钾溶液的作用为_______ 。
(4)能说明碳元素的非金属性比硅元素的非金属性强的实验现象是_______ 。
(5)该实验是否能证明S的非金属性强于C的非金属性_______ (填“能”或“不能”)。

(1)仪器B的名称为
(2)实验步骤:①连接仪器,②
(3)铜与浓硫酸反应的化学方程式为
(4)能说明碳元素的非金属性比硅元素的非金属性强的实验现象是
(5)该实验是否能证明S的非金属性强于C的非金属性
您最近一年使用:0次
2022-09-05更新
|
317次组卷
|
2卷引用:四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题
解题方法
4 . 化合物M由三种短周期元素组成,某实验小组按如图流程进行相关实验:

固体混合物A为一种单质和一种化合物,溶液C中只有一种溶质。请回答:
(1)组成M的三种元素为____ ;M的化学式为____ 。
(2)溶液C的溶质为____ (用化学式表示)。
(3)①写出由M到A的化学方程式____ 。
②固体混合物A中某化合物在高温下无水环境可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为____ 。
(4)设计实验,检验溶液C与过量CO2反应后溶液中的溶质____ 。

固体混合物A为一种单质和一种化合物,溶液C中只有一种溶质。请回答:
(1)组成M的三种元素为
(2)溶液C的溶质为
(3)①写出由M到A的化学方程式
②固体混合物A中某化合物在高温下无水环境可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为
(4)设计实验,检验溶液C与过量CO2反应后溶液中的溶质
您最近一年使用:0次
名校
解题方法
5 . 市政污泥含大量金属(Cu、Zn、Ni、Fe、Ag等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并完全可以作为资源再次为我们所利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾( )的工艺流程如下:
)的工艺流程如下:

已知:除铁时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀,回答下列问题:
(1)为提高“浸出”效率,可采取的措施有_______ 、_______ (写两条)。
(2)根据流程图可知Cu、Zn、Ni的金属性强弱顺序为_______ 。
(3)置换镍时,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含 溶液中同时加入锌粉和
溶液中同时加入锌粉和 得到金属Ni和Sb的混合物,该混合物可表示为
得到金属Ni和Sb的混合物,该混合物可表示为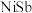 ,形成
,形成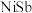 的离子方程式为
的离子方程式为_______ 。
(4)“浸出”的浸渣中含有 ,经一系列处理得
,经一系列处理得 ,用肼(
,用肼( )还原
)还原 得到单质银,
得到单质银, 的氧化产物为
的氧化产物为 ,则还原过程中氧化剂与还原剂的物质的量之比为
,则还原过程中氧化剂与还原剂的物质的量之比为_______ 。
(5)浸出液中含有 ,“除铁”步骤中发生反应的离子方程式为
,“除铁”步骤中发生反应的离子方程式为_______ 。调节pH对不同金属沉出率的影响如下图所示,则沉铁时最合理的pH约为_______ 。

 )的工艺流程如下:
)的工艺流程如下:
已知:除铁时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀,回答下列问题:
(1)为提高“浸出”效率,可采取的措施有
(2)根据流程图可知Cu、Zn、Ni的金属性强弱顺序为
(3)置换镍时,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含
 溶液中同时加入锌粉和
溶液中同时加入锌粉和 得到金属Ni和Sb的混合物,该混合物可表示为
得到金属Ni和Sb的混合物,该混合物可表示为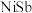 ,形成
,形成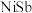 的离子方程式为
的离子方程式为(4)“浸出”的浸渣中含有
 ,经一系列处理得
,经一系列处理得 ,用肼(
,用肼( )还原
)还原 得到单质银,
得到单质银, 的氧化产物为
的氧化产物为 ,则还原过程中氧化剂与还原剂的物质的量之比为
,则还原过程中氧化剂与还原剂的物质的量之比为(5)浸出液中含有
 ,“除铁”步骤中发生反应的离子方程式为
,“除铁”步骤中发生反应的离子方程式为
您最近一年使用:0次
解题方法
6 . 某化学兴趣小组设计实验来测定某种天然黄铜矿(主要成分是CuFeS2,含SiO2杂质)的纯度。
(1)实验装置合理的连接顺序为____ 。

(2)现称取样品2.5g,研细后放在装置A的硬质玻璃管中煅烧。将黄铜矿研细的目的是____ ,装置B的作用是____ 。
(3)上述实验在反应后还要通入一段时间空气,其作用是____ (填标号,可以多选)。
a.除去SO2气体 b.有利于气体混合
c.除去反应后多余的氧气 d.使反应生成的SO2全部进入C装置中,使结果精确
(4)实验后取C中溶液的 于锥形瓶中,用0.05mol/L标准碘溶液进行滴定。滴定时主要发生的反应化学方程式是
于锥形瓶中,用0.05mol/L标准碘溶液进行滴定。滴定时主要发生的反应化学方程式是____ 。若达终点时,消耗标准溶液20.00mL,则黄铜矿的纯度为____ 。
(5)装置D可除去空气中的水蒸气,还能观察空气流速,若流速过快,可能会导致测定结果____ (填“偏高”“偏低”或“无影响”)。
(6)若将装置C中的溶液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有____ (写出一点即可)。
(1)实验装置合理的连接顺序为

(2)现称取样品2.5g,研细后放在装置A的硬质玻璃管中煅烧。将黄铜矿研细的目的是
(3)上述实验在反应后还要通入一段时间空气,其作用是
a.除去SO2气体 b.有利于气体混合
c.除去反应后多余的氧气 d.使反应生成的SO2全部进入C装置中,使结果精确
(4)实验后取C中溶液的
 于锥形瓶中,用0.05mol/L标准碘溶液进行滴定。滴定时主要发生的反应化学方程式是
于锥形瓶中,用0.05mol/L标准碘溶液进行滴定。滴定时主要发生的反应化学方程式是(5)装置D可除去空气中的水蒸气,还能观察空气流速,若流速过快,可能会导致测定结果
(6)若将装置C中的溶液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有
您最近一年使用:0次
解题方法
7 . M为三种短周期元素组成的化合物,某实验小组按如图流程进行相关实验:

已知:气体A是由两种常见单质组成的混合物,一种为无色气体,另一种为黄绿色气体。
(1)组成M的三种元素____ (填元素符号);M分解的化学方程式____ 。
(2)气体A中黄绿色成分与硫单质反应,生成结构与H2O2相似的产物G,G的电子式____ ,G遇水反应生成沉淀、气体,写出反应的化学方程式____ 。
(3)写出E→F的离子方程式____ 。
(4)设计实验证明B→C过程中,加入的BaCl2溶液已经过量____ 。

已知:气体A是由两种常见单质组成的混合物,一种为无色气体,另一种为黄绿色气体。
(1)组成M的三种元素
(2)气体A中黄绿色成分与硫单质反应,生成结构与H2O2相似的产物G,G的电子式
(3)写出E→F的离子方程式
(4)设计实验证明B→C过程中,加入的BaCl2溶液已经过量
您最近一年使用:0次
名校
8 . 现有 的
的 ,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的
,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的 能和浓盐酸反应放出
能和浓盐酸反应放出 。
。 受热可分解为
受热可分解为 的+4、+2价的混合氧化物并放出
的+4、+2价的混合氧化物并放出 )。则下列说法中正确的是
)。则下列说法中正确的是
 的
的 ,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的
,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的 能和浓盐酸反应放出
能和浓盐酸反应放出 。
。 受热可分解为
受热可分解为 的+4、+2价的混合氧化物并放出
的+4、+2价的混合氧化物并放出 )。则下列说法中正确的是
)。则下列说法中正确的是A.气体1的物质的量最多为 |
B.若物质的量,气体 气体 气体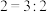 ,则固体的成分为物质的量之比可能为 ,则固体的成分为物质的量之比可能为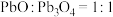 |
C.若物质的量,气体 气体 气体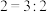 ,则固体a的成分为物质的量之比可能为 ,则固体a的成分为物质的量之比可能为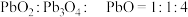 |
D.气体总物质的量可能为 |
您最近一年使用:0次
2022-08-17更新
|
479次组卷
|
2卷引用:湖南省邵阳市第二中学2022-2023学年高三上学期第三次月考化学试题
解题方法
9 . 含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取 的化学方程式为
的化学方程式为_______ 。
(2)实验室制取干燥 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为_______ 。

(3)某氯水久置后不能使品红溶液褪色,可推测氯水中_______ 已分解。检验此久置氯水中 存在的操作及现象是
存在的操作及现象是_______ 。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度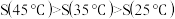
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
⑤数据分析、交流讨论
实验结果为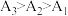 。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有
。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有_______ 。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5,请完成表2中内容。
表2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是_______ 。
 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。(1)实验室沿用舍勒的方法制取
 的化学方程式为
的化学方程式为(2)实验室制取干燥
 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中
 存在的操作及现象是
存在的操作及现象是(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度
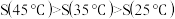
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
| 实验序号 | 试样 | 测试温度/℃ | 电导率/( ) ) |
| 1 | Ⅰ:25℃的AgCl饱和溶液 | 25 | A1 |
| 2 | Ⅱ:35℃的AgCl饱和溶液 | 35 | A2 |
| 3 | Ⅲ:45℃的AgCl饱和溶液 | 45 | A3 |
实验结果为
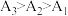 。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有
。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5,请完成表2中内容。
表2
| 实验序号 | 试样 | 测试温度/℃ | 电导率/( ) ) |
| 4 | Ⅰ | B1 | |
| 5 | B2 |
您最近一年使用:0次
2022-08-17更新
|
407次组卷
|
2卷引用:福建省福清市一级达标校2022-2023学年高三上学期期中联考化学试题
解题方法
10 . 碱式碳酸铜在有机催化、电镀、防腐、烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(主要成分为Cu2S,含有SiO2和少量Fe2O3等杂质)为原料制备碱式碳酸铜的流程如图所示:
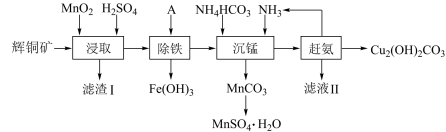
已知:
①有关金属离子形成氢氧化物沉淀的pH范围如下:
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③Ksp[Fe(OH)3] = 4.0 ×10-38;
④S在CS2中的溶解度随温度升高而增大;
⑤CS2的沸点: 46.2°C。
回答下列问题:
(1)为了加快辉铜矿的“浸取”速率,可采取的措施有_______ (任写一种)。
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分有_______ (填化学式)。回收该淡黄色副产品过程中必须控制适宜的温度,不宜过高或过低的原因是_______ , “浸取” 过程中,辉铜矿中的Cu2S与MnO2及稀硫酸反应的离子方程式为_______ 。
(3)常温下,加入的试剂A若为CuO,其“除铁”的原理是_______ (从平衡移动的角度进行解释),调节pH的范围为________ ,加一定量的CuO后,若测得溶液的pH为4,则溶液中Fe3+的浓度为_______ mol·L-1。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式_______ 。

已知:
①有关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀的pH | 9.0 | 3.7 | 6.7 | 9.8 |
③Ksp[Fe(OH)3] = 4.0 ×10-38;
④S在CS2中的溶解度随温度升高而增大;
⑤CS2的沸点: 46.2°C。
回答下列问题:
(1)为了加快辉铜矿的“浸取”速率,可采取的措施有
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分有
(3)常温下,加入的试剂A若为CuO,其“除铁”的原理是
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式
您最近一年使用:0次



