名校
解题方法
1 . 溶液X中含有下表离子中的某5种,且其浓度均为 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是阳离子 | 阴离子 |
|
|
| A.X溶液中可能含3种阳离子、2种阴离子 | B.X溶液中不可能含有 或 或 |
C.生成的无色气体是 | D.根据电荷守恒,原溶液中一定含 |
您最近一年使用:0次
2023-04-20更新
|
1289次组卷
|
9卷引用:辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题
辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题黑龙江省鹤岗市绥滨县第一中学2021-2022学年高三上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题辽宁省沈阳市铁路实验中学2022-2023学年高一下学期第一次月考化学试题河北省石家庄市第二中学2023-2024高一上学期第一次诊断测评化学试题
名校
2 . 向两份20 ml 0.1 mol/LBa(OH)2溶液中各加入定量的KAl(SO4)2和Al2(SO4)3溶液的导电性随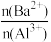 (混合前)的变化关系如图所示,下列分析不正确的是
(混合前)的变化关系如图所示,下列分析不正确的是
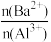 (混合前)的变化关系如图所示,下列分析不正确的是
(混合前)的变化关系如图所示,下列分析不正确的是
| A.a点溶液的pH值约为7 | B.b点溶液中大量存在的阳离子有Al3+和Ba2+ |
| C.c、d两点溶液中OH-均已完全反应 | D.②代表加入Al2(SO4)3的变化曲线 |
您最近一年使用:0次
2023-01-05更新
|
967次组卷
|
3卷引用:安徽省皖南八校2022-2023学年高三上学期第一次大联考化学试题
解题方法
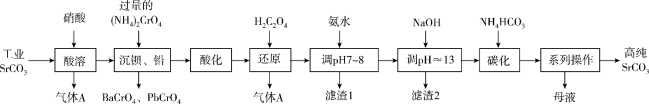
3 . 碳酸锶(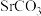 )常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
)常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:
已知:I.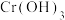 为两性氢氧化物;
为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的化学式为_______ ;基态Cr原子的价层电子排布图为_______ 。
(2)酸溶时为了加快酸溶速率,可适当升高温度,但升温度又不能过高的原因是_______ 。
(3)“系列操作”是煮沸并趁热过滤、_______ 。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ (用化学方程式回答)。
(5)“调pH≈13”后,需对溶液进行煮沸并趁热过滤出“滤渣2”,“滤渣2”的主要成分为_______ (填化学式);要煮沸并趁热过滤的目的是_______ 。
(6)“还原”时含Cr微粒发生反应的离子方程式为_______ 。
(7)“碳化”时,实际所用 的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
_______ t(保留到小数点后两位)。
 )常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量
)常用于制造彩电阴极射线管、电磁铁、锶铁氧体、烟火、荧光玻璃、信号弹等,也是生产其他锶盐的原料。一种由工业碳酸锶(含少量 、
、 、
、 、
、 等)制备高纯碳酸锶的工艺流程如下:
等)制备高纯碳酸锶的工艺流程如下:
已知:I.
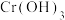 为两性氢氧化物;
为两性氢氧化物;II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | 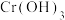 |  |  | 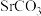 |
 近似值 近似值 | 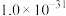 | 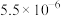 | 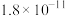 | 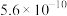 |
(1)气体A的化学式为
(2)酸溶时为了加快酸溶速率,可适当升高温度,但升温度又不能过高的原因是
(3)“系列操作”是煮沸并趁热过滤、
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH≈13”后,需对溶液进行煮沸并趁热过滤出“滤渣2”,“滤渣2”的主要成分为
(6)“还原”时含Cr微粒发生反应的离子方程式为
(7)“碳化”时,实际所用
 的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
的量为理论用量的111%,若要提纯1t含量为98%的工业碳酸锶,流程中的损失不计,“碳化”步骤中应加入
您最近一年使用:0次
4 . 铟(In)是一种主要用于液晶显示屏和半导体生产的重要稀有金属。从铅、锌的冶炼过程中产生的高铟烟灰(主要含ZnO、PbO、Fe2O3、In2O3、In2S3)中提取铟的流程如图:

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是____ 。
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是____ (用化学方程式表示)。
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有____ (填化学式)。
(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=____ (已知lg19=1.28忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为____ mol•L-1。

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为____ 。

已知:滤液中铟以In3+的形式存在,In3+与Al3+相似,易水解。
回答下列问题:
(1)“氧化酸浸”需要加热,其目的是
(2)“氧化酸浸”时不能用浓盐酸代替硫酸,理由是
(3)“氧化酸浸”过程中In2S3的硫元素被氧化为SO
 ,滤渣除含过量MnO2外,还有
,滤渣除含过量MnO2外,还有(4)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程In3+发生的反应方程式为:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K。“萃取”时萃取率的高低受溶液的pH影响很大,已知与萃取率(E%)的关系符合如下公式:lg =lgK-lg
=lgK-lg 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(5)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为

(6)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为
您最近一年使用:0次
2022-10-29更新
|
608次组卷
|
3卷引用:吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题
解题方法
5 . 一种测定黄铁矿(主要成分为FeS2,杂质不含硫)中硫含量的实验原理及步骤如下:

已知:I.2FeS2+15Na2O2 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;
II.Pb2++ =PbSO4↓;
=PbSO4↓;
III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为_______ mol。
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为_______ 。
(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是_______ 。
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为_______ (填字母)。
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为_______ (用含c、V的代数式表示)。
③下列情形下会使测得的硫的质量分数偏大的是_______ (填字母)。
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视

已知:I.2FeS2+15Na2O2
 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;II.Pb2++
 =PbSO4↓;
=PbSO4↓;III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3
 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为
③下列情形下会使测得的硫的质量分数偏大的是
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视
您最近一年使用:0次
解题方法
6 . W、X、Y、Z元素的原子序数依次增大,W、Y的最外层电子数之和等于X的内层电子数,W、Z的质子数之和与X、Y的质子数之和的差等于X的最外层电子数;W、Z形成的单质是生产、生活中应用最广的两种金属。回答下列问题:
(1)Z元素在元素周期表中的位置为_______ 。
(2)Z形成的单质与水蒸气在高温下反应,生成的固体产物与W形成的单质在高温下也可反应,则后一个反应的还原剂与还原产物的物质的量之比为_______ 。
(3)用电子式表示X形成化合物H2X的过程:_______ 。
(4)Z形成的最高价含氧酸盐具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是
,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是_______ 。
(5)写出能体现X、Y金属性或非金属性强弱的方法:_______ (用化学方程式表示)。
(1)Z元素在元素周期表中的位置为
(2)Z形成的单质与水蒸气在高温下反应,生成的固体产物与W形成的单质在高温下也可反应,则后一个反应的还原剂与还原产物的物质的量之比为
(3)用电子式表示X形成化合物H2X的过程:
(4)Z形成的最高价含氧酸盐具有强氧化性,在酸性或中性溶液中快速产生
 ,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是
,在碱性溶液中较稳定,可用于饮用水的处理,其净水原理是(5)写出能体现X、Y金属性或非金属性强弱的方法:
您最近一年使用:0次
2022-09-29更新
|
903次组卷
|
2卷引用:河南省豫北名校普高联考2022-2023学年上学期高三测评(一)化学试题
名校
解题方法
7 . 固体盐X由四种常见元素组成,其中仅含一种金属元素,有如图转化关系:
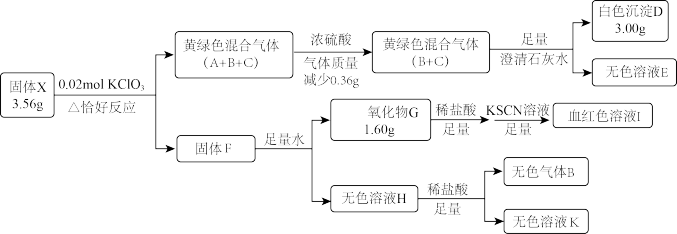
已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为_______ ,固体F成分为_______ 。
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式_______ 。
(3)气体C的化学式为_______ 。将气体C通入KOH溶液,微热,恰好完全反应,生成两种物质的量之比1∶5的盐,写出这两种盐的化学式_______ ,设计定量实验方案验证上述比例关系_______ 。(已知AgClO3溶于水,NaNO2能将ClO3-还原为Cl-)

已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式
(3)气体C的化学式为
您最近一年使用:0次
解题方法
8 . 化合物M由三种短周期元素组成,某实验小组按如图流程进行相关实验:

固体混合物A为一种单质和一种化合物,溶液C中只有一种溶质。请回答:
(1)组成M的三种元素为____ ;M的化学式为____ 。
(2)溶液C的溶质为____ (用化学式表示)。
(3)①写出由M到A的化学方程式____ 。
②固体混合物A中某化合物在高温下无水环境可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为____ 。
(4)设计实验,检验溶液C与过量CO2反应后溶液中的溶质____ 。

固体混合物A为一种单质和一种化合物,溶液C中只有一种溶质。请回答:
(1)组成M的三种元素为
(2)溶液C的溶质为
(3)①写出由M到A的化学方程式
②固体混合物A中某化合物在高温下无水环境可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为
(4)设计实验,检验溶液C与过量CO2反应后溶液中的溶质
您最近一年使用:0次
解题方法
9 . M为三种短周期元素组成的化合物,某实验小组按如图流程进行相关实验:

已知:气体A是由两种常见单质组成的混合物,一种为无色气体,另一种为黄绿色气体。
(1)组成M的三种元素____ (填元素符号);M分解的化学方程式____ 。
(2)气体A中黄绿色成分与硫单质反应,生成结构与H2O2相似的产物G,G的电子式____ ,G遇水反应生成沉淀、气体,写出反应的化学方程式____ 。
(3)写出E→F的离子方程式____ 。
(4)设计实验证明B→C过程中,加入的BaCl2溶液已经过量____ 。

已知:气体A是由两种常见单质组成的混合物,一种为无色气体,另一种为黄绿色气体。
(1)组成M的三种元素
(2)气体A中黄绿色成分与硫单质反应,生成结构与H2O2相似的产物G,G的电子式
(3)写出E→F的离子方程式
(4)设计实验证明B→C过程中,加入的BaCl2溶液已经过量
您最近一年使用:0次
2018高三·全国·专题练习
名校
解题方法
10 . 实验探究是进行科学发现、创造的实践活动。某溶液X中可能含有 、Cl-、
、Cl-、 、
、 、
、 、Fe2+、Fe3+、A13+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:
、Fe2+、Fe3+、A13+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:

则下列说法正确的是
 、Cl-、
、Cl-、 、
、 、
、 、Fe2+、Fe3+、A13+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:
、Fe2+、Fe3+、A13+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:
则下列说法正确的是
| A.若含有Fe3+,一定含有Cl-、K+ |
B. 、 、 一定存在, 一定存在, 、Cl-可能不存在 、Cl-可能不存在 |
C. 、A13+、K+一定不存在 、A13+、K+一定不存在 |
| D.气体甲、沉淀甲一定为纯净物 |
您最近一年使用:0次
2021-02-07更新
|
2343次组卷
|
10卷引用:解密04 离子反应——备战2018年高考化学之高频考点解密 张燕
(已下线)解密04 离子反应——备战2018年高考化学之高频考点解密 张燕(已下线)【浙江新东方】高中化学20210304-010黑龙江省大庆铁人中学2022届高三上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高三上学期10月月考化学试题江西省宜春市丰城市第九中学2023-2024学年高三上学期12月月考化学试题浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008浙江省宁波市慈溪市2020-2021学年高二下学期期末测试化学试题江西省丰城市第九中学2021-2022学年高一上学期期末考试化学试题福建省泉州市永春第一中学2022-2023学年高一上学期期末考试化学试题

 、
、 、
、 、
、
 、
、 、
、 、
、


