解题方法
1 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)现有铁和铜的混合物,可以通过___________ 把他们分开。
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:___________ 。
反应后的废液中含有Fe3+,可以用___________ 检验。
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。___________ ,黄绿色气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式___________ 。
(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,___________ (补全实验现象),此过程涉及氧化还原反应的化学方程式是___________ 。
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________ 。
(1)现有铁和铜的混合物,可以通过
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:
反应后的废液中含有Fe3+,可以用
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
您最近半年使用:0次
解题方法
2 . 某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是___________ 。
(2)写出KAl(SO4)2在水中的电离方程式___________ 。
(3)已知H+ +[Al(OH)4]- = Al(OH)3↓+ H2O,根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B___________ ;沉淀D___________ ;溶液E是K2SO4和___________ 。
(4)写出①②反应的离子方程式。
①___________ 。
②___________ 。
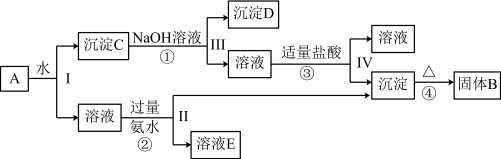
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
(2)写出KAl(SO4)2在水中的电离方程式
(3)已知H+ +[Al(OH)4]- = Al(OH)3↓+ H2O,根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B
(4)写出①②反应的离子方程式。
①
②
您最近半年使用:0次
名校
解题方法
3 . 絮凝剂聚合氯化铝{ ,
, }广泛用于废水处理。由偏铝酸钙
}广泛用于废水处理。由偏铝酸钙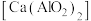 制备聚合氯化铝的一种工艺流程如下:
制备聚合氯化铝的一种工艺流程如下: 的絮凝效果可用盐基度(盐基度
的絮凝效果可用盐基度(盐基度 )衡量,当盐基度为0.60~0.85时,絮凝效果较好。
)衡量,当盐基度为0.60~0.85时,絮凝效果较好。
(1)“碱溶”时,化学反应方程式为___________ 。
(2)若滤液浓度较大,则通入过量 不利于减少
不利于减少 滤饼中的杂质,其原因是
滤饼中的杂质,其原因是___________ 。
(3)“酸化”时的装置如图所示,仪器A的名称为___________ ,若要使产品盐基度为 ,则
,则
___________ ;先将 滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是
滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是____________ 。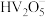 、
、 的碱性废水制取聚合氯化铝的实验方案:取适量废水,
的碱性废水制取聚合氯化铝的实验方案:取适量废水,___________ ,向其中滴加一定量的盐酸,得到聚合氯化铝。(实验中须使用的试剂有: 、5%的双氧水、蒸馏水、
、5%的双氧水、蒸馏水、 溶液)
溶液)
 ,
, }广泛用于废水处理。由偏铝酸钙
}广泛用于废水处理。由偏铝酸钙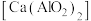 制备聚合氯化铝的一种工艺流程如下:
制备聚合氯化铝的一种工艺流程如下: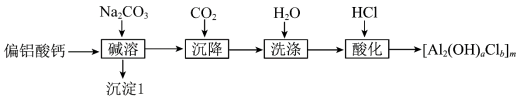
 的絮凝效果可用盐基度(盐基度
的絮凝效果可用盐基度(盐基度 )衡量,当盐基度为0.60~0.85时,絮凝效果较好。
)衡量,当盐基度为0.60~0.85时,絮凝效果较好。(1)“碱溶”时,化学反应方程式为
(2)若滤液浓度较大,则通入过量
 不利于减少
不利于减少 滤饼中的杂质,其原因是
滤饼中的杂质,其原因是(3)“酸化”时的装置如图所示,仪器A的名称为
 ,则
,则
 滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是
滤饼分散在蒸馏水中,再向其中滴加一定量的盐酸,与直接向滤饼中加盐酸相比,优点是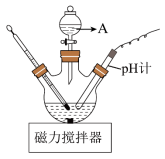
 、
、 的碱性废水制取聚合氯化铝的实验方案:取适量废水,
的碱性废水制取聚合氯化铝的实验方案:取适量废水, 、5%的双氧水、蒸馏水、
、5%的双氧水、蒸馏水、 溶液)
溶液)| 化合价 |  |  |
| +4价V |  沉淀 沉淀 | 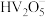 |
| +5价V |  |  |
| +3价Al |  沉淀 沉淀 |  |
您最近半年使用:0次
名校
4 . 已知A、B、C、D、E、F、G、H是原子序数依次增大的短周期主族元素,已知A的某种原子核内没有中子,A和D,C和G分别为同一主族元素,B原子的最外层电子数比次外层多3,F的最高价氧化物的水化物既可以和强酸反应也可以和强碱溶液反应,G的单质常出现在火山口。
(1)C在元素周期表中的位置是_______ 。
(2)C、D分别形成的简单离子中,半径较大的是______ (填离子符号)。
(3)G和H的最高价氧化物的水化物酸性较强的是______ (填化学式)。
(4)由A、C、D形成的化合物中化学键的类型为_______ ,C、D形成摩尔质量为 的化合物的电子式为
的化合物的电子式为______ ,由A、B形成 化合物的结构式为
化合物的结构式为______ 。
(5)甲烷可与 组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式
组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式_______ 。
(6)D、F的最高价氧化物的水化物相互反应的离子方程式为_______ 。
(7)可用湿润的______ 试纸检验H对应单质,涉及反应的离子方程式为_______ 。
(8)由B、H形成的化合物分子中,B和H原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:________ 。
(9)E与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中E元素的含量。(装置中因空气质量引起的误差忽略不计)实验需要测定三个物理量:合金的质量m,反应前装置和药品的总质量a以及反应后装置和药品的总质量b,合金中E元素的质量分数是______ (用含m、a、b的式子表示)。
(1)C在元素周期表中的位置是
(2)C、D分别形成的简单离子中,半径较大的是
(3)G和H的最高价氧化物的水化物酸性较强的是
(4)由A、C、D形成的化合物中化学键的类型为
 的化合物的电子式为
的化合物的电子式为 化合物的结构式为
化合物的结构式为(5)甲烷可与
 组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式
组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式(6)D、F的最高价氧化物的水化物相互反应的离子方程式为
(7)可用湿润的
(8)由B、H形成的化合物分子中,B和H原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:
(9)E与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中E元素的含量。(装置中因空气质量引起的误差忽略不计)实验需要测定三个物理量:合金的质量m,反应前装置和药品的总质量a以及反应后装置和药品的总质量b,合金中E元素的质量分数是
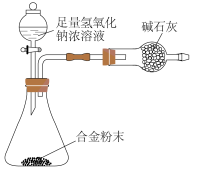
您最近半年使用:0次
7日内更新
|
95次组卷
|
2卷引用:福建省厦门双十中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
5 . 五种短周期元素在周期表中的位置如图所示。已知:W元素原子的最外层电子数是次外层的2倍,下列说法正确的是

| A.5种元素最高价氧化物的水化物都是酸 |
| B.WZ4、MX2中所含化学键类型相同,熔点都很高 |
| C.简单氢化物的稳定性:X>Y |
| D.只有一种X的氢化物与Y的氧化物发生反应生成强酸 |
您最近半年使用:0次
解题方法
6 . 桂皮中含有的肉桂醛是一种食用香料,工业上可通过如下反应制备肉桂醛: 为阿伏伽德罗常数的值。下列说法正确的是
为阿伏伽德罗常数的值。下列说法正确的是
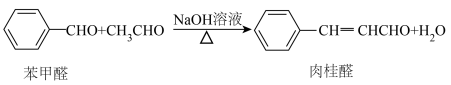
 为阿伏伽德罗常数的值。下列说法正确的是
为阿伏伽德罗常数的值。下列说法正确的是A.0.5mol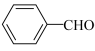 分子中含有的σ键数目为 分子中含有的σ键数目为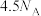 |
B.标准状况下, 含有的π键数目为 含有的π键数目为 |
C.1mol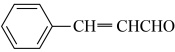 中 中 杂化的碳原子数为 杂化的碳原子数为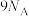 |
D.1L0.1mol/LNaOH溶液中含有的氧原子数目为 |
您最近半年使用:0次
7 . 短周期元素A、B、C、D的原子序数依次增大,A元素原子的核外电子只有一种运动状态:基态B原子s能级的电子总数比p能级的多1;基态C原子中成对电子数是未成对电子数的3倍;D形成简单离子的半径在同周期元素形成的简单离子中最小。回答下列问题
(1)B原子的轨道表示式___________ 。
(2)A和C原子个数比为1∶1的化合物的电子式___________ 。
(3)元素A、B、C中,第一电离能最大的是___________ (填元素名称)。
(4)在B、C、D三种元素的简单离子中,其离子的半径最小的是___________ 。(填离子符号)
(5)C的简单氢化物的键角小于B的简单氢化物,其原因是___________ 。
(6)BC₃的空间结构为___________ 。
(7)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB晶体的密度为a g⋅cm ,则晶体中两个最近D原子之间的距离为
,则晶体中两个最近D原子之间的距离为___________ pm(用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
(1)B原子的轨道表示式
(2)A和C原子个数比为1∶1的化合物的电子式
(3)元素A、B、C中,第一电离能最大的是
(4)在B、C、D三种元素的简单离子中,其离子的半径最小的是
(5)C的简单氢化物的键角小于B的简单氢化物,其原因是
(6)BC₃的空间结构为
(7)化合物DB是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。若DB晶体的密度为a g⋅cm
 ,则晶体中两个最近D原子之间的距离为
,则晶体中两个最近D原子之间的距离为 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。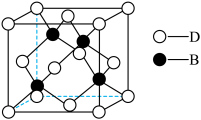
您最近半年使用:0次
8 . 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表列出了七种元素在元素周期表中的位置,回答下列问题:
(1)表中C在周期表的位置是___________ 。
(2)元素E与元素H相比,金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ (填字母序号)。
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:___________ ;画出氧离子的结构示意图:___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | ||||||
| 4 | H |
(2)元素E与元素H相比,金属性较强的是
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:
您最近半年使用:0次
名校
解题方法
9 . 下列电离方程式的书写正确的是
A.水溶液中:NaHCO3=Na++H++CO | B.H2CO3的电离:H2CO3 2H++CO 2H++CO |
C.Fe(OH)3的电离:Fe(OH)3 Fe3++3OH- Fe3++3OH- | D.水溶液中HF的电离:HF=H++F- |
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
10 . 探究pH对 溶液的配制和保存的影响。
溶液的配制和保存的影响。
I. 溶液的配制
溶液的配制
将 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
II. 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
(1)①中的浑浊主要是FeOOH,用离子方程式表示其生成过程_______ 。
(2)该实验的初步结论:保存 溶液的最佳pH是
溶液的最佳pH是_______ 。
(3)进一步探究pH对 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;
ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因_______ 。
b.依据实验i和ii推断:③比②中 更易变质的原因是
更易变质的原因是_______ 。
c.按上述原理进行实验,证实①中 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,_______ 。
 溶液的配制和保存的影响。
溶液的配制和保存的影响。I.
 溶液的配制
溶液的配制将
 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:| 编号 | 溶剂 | 溶液性状 | |
| ① | 蒸馏水 | 浅黄色澄清溶液 |  ;滴加1mol/LKSCN溶液无明显变化 ;滴加1mol/LKSCN溶液无明显变化 |
| ② |  | 无色澄清溶液 |  ;滴加1mol/LKSCN溶液微微变红 ;滴加1mol/LKSCN溶液微微变红 |
| ③ |  | 无色澄清溶液 | 滴加1mol/LKSCN溶液微微变红 |
 溶液的保存
溶液的保存将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
| 编号 | 溶液性状 | |
| ① | 橙色浑浊 | 用 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 |
| ② | 无色溶液 | 滴加1mol/L的KSCN溶液后显浅红色 |
| ③ | 无色溶液 | 滴加1mol/L的KSCN溶液后显红色,颜色比②略深 |
(2)该实验的初步结论:保存
 溶液的最佳pH是
溶液的最佳pH是(3)进一步探究pH对
 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: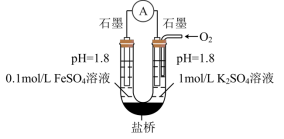
 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因
b.依据实验i和ii推断:③比②中
 更易变质的原因是
更易变质的原因是c.按上述原理进行实验,证实①中
 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
您最近半年使用:0次



