名校
1 . 下列操作能达到相应实验目的的是
| 实验目的 | 操作 | |
| A | 检验 溶液是否变质 溶液是否变质 | 取少量加入到酸性 溶液中 溶液中 |
| B | 测定家用84消毒液的 | 用洁净的玻璃棒蘸取少许消毒液滴在 试纸上 试纸上 |
| C | 除去 中的少量 中的少量 | 将混合气体通过盛有饱和 溶液的洗气瓶 溶液的洗气瓶 |
| D | 实验室制备 胶体 胶体 | 向沸水中逐滴加入饱和 溶液,边加边搅拌 溶液,边加边搅拌 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-25更新
|
276次组卷
|
2卷引用:江苏省响水中学2021-2022学年高二下学期开学测试化学试题
2 . 下列由废催化剂(主要含FeBr3及少量溴、苯)制取无水FeCl3的实验装置与原理能达到实验目的的是
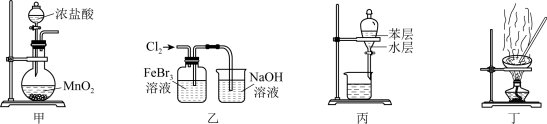
| A.用装置甲制取氯气 |
| B.用装置乙氧化FeBr3溶液中的溴离子 |
| C.用装置丙分离出FeCl3溶液 |
| D.用装置丁蒸干溶液可得无水FeCl3 |
您最近一年使用:0次
2022-01-20更新
|
1065次组卷
|
12卷引用:江苏省南通市海安市实验中学2023-2024学年高二上学期11月期中化学试题
江苏省南通市海安市实验中学2023-2024学年高二上学期11月期中化学试题江苏省南京市六校联合体2023-2024学年高二下学期四月联考化学试卷江苏省无锡市普通高中2021-2022学年上学期高三期末调研考试化学试题(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第3题 化学实验基础知识和技能 -备战2022年高考化学临考题号押题(江苏卷)河南省五市2022届高三下学期第二次联合调研检测(二模)理综化学试题江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题湖南省郴州市第二中学2022届高三下学期期中考试化学试题江苏省常熟中学2023-2024学年高三上学期阶段性抽测一化学试题2024届江苏省常熟市中学高三上学期阶段性抽测一 化学试题江苏省扬州中学2023-2024学年高三下学期阶段练习化学试题江苏省扬州中学2024届高三下学期3月月考化学试卷
名校
解题方法
3 . 以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)。
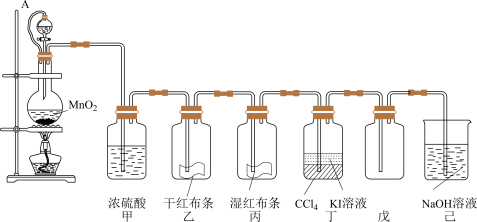
试回答下列问题:
(1)乙和丙中的现象分别是_____ ;由上述现象可得出结论:_____ (写化学式)具有漂白作用;
(2)圆底烧瓶内发生反应的化学方程式为_____ ;分液漏斗与烧瓶连接橡皮管的目的是_____ ;
(3)ClO2气体是一种新型高效含氯消毒剂。实验室可通过以下反应制2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。若反应共产生了0.2mol气体,消耗还原剂的质量为_____ g。ClO2的有效氯含量为_____ (有效氯含量指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力)。
(4)用ClO2气体可去除地下水中Mn2+,生成难溶于水的MnO2,该反应的离子方程式为_____ 。

试回答下列问题:
(1)乙和丙中的现象分别是
(2)圆底烧瓶内发生反应的化学方程式为
(3)ClO2气体是一种新型高效含氯消毒剂。实验室可通过以下反应制2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。若反应共产生了0.2mol气体,消耗还原剂的质量为
(4)用ClO2气体可去除地下水中Mn2+,生成难溶于水的MnO2,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
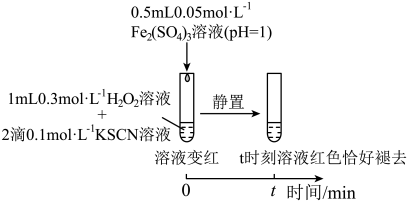
4 . 某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验I:
(1)实验I中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是__ 。
(2)探究实验I中红色褪去的原因:取反应后溶液,___ (填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
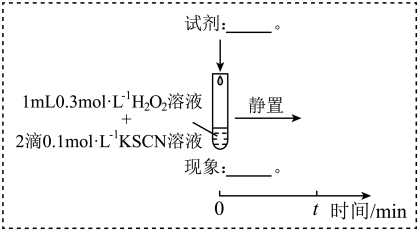
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:__ 。
实验II:
实验III:
(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,___ 。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:____ 。
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有___ 。
实验I:
| 装置与操作 | 现象 |
 | 溶液立即变红,继续滴加H2O2溶液,红色变浅并逐渐褪去 |
(2)探究实验I中红色褪去的原因:取反应后溶液,
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:
实验II:

实验III:

(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

①t′<t,对比实验IV和II可得出结论:在本实验条件下,
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有
您最近一年使用:0次
2021-08-13更新
|
633次组卷
|
7卷引用:北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题
名校
解题方法
5 . 回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为___________ mol。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。___________
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。
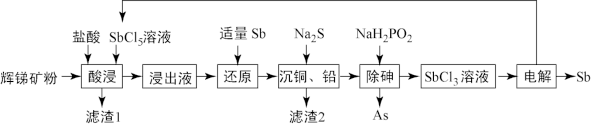
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是___________ (填化学式)。
(5)写出“还原”反应的化学方程式___________ 。
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(5)写出“还原”反应的化学方程式
您最近一年使用:0次
2021-07-28更新
|
1110次组卷
|
3卷引用:吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题
名校
6 . 金属钒被誉为“合金的维生素",常用于催化剂和新型电池。工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:、

[资料]:+5价钒在溶液中的主要存在形式与溶液pH的关系:
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是_________ 。
(2)酸浸:
①Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH = 4,Ca(VO3)2溶于盐酸的离子方程式_______ 。
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%, 根据下图推测,酸浸时不选择更高酸度的原因是______________ 。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:

①浸出液中加入石灰乳的作用是______________ 。
②向(NH)3VO4溶液中加入NH4C1溶液,控制溶液的pH=7.5。当pH>8时,_______ (用离子反应式表示)。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,配成200 mL (VO2)2SO4溶液,取20 mL溶液置于锥形瓶中,再加入b1 mL c1 mol·L-1 (NE4)2Fe(SO4)2,溶液( +2H++Fe2+ =VO2++Fe3++H2O)。最后用c2 mol.L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至
+2H++Fe2+ =VO2++Fe3++H2O)。最后用c2 mol.L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至__________ (填现象),表示到达滴定终点,消耗KMnO4溶液的体积为b2 mL。已知 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是________ 。如果所用的(NH4)2Fe(SO4)2溶液因露空放置太久而变质,会导致测定的结果__________ (填"偏大"、“不变"或“偏小")。

[资料]:+5价钒在溶液中的主要存在形式与溶液pH的关系:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  | 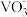 | 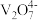 | 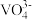 |
(2)酸浸:
①Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH = 4,Ca(VO3)2溶于盐酸的离子方程式
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%, 根据下图推测,酸浸时不选择更高酸度的原因是

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:

①浸出液中加入石灰乳的作用是
②向(NH)3VO4溶液中加入NH4C1溶液,控制溶液的pH=7.5。当pH>8时,
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,配成200 mL (VO2)2SO4溶液,取20 mL溶液置于锥形瓶中,再加入b1 mL c1 mol·L-1 (NE4)2Fe(SO4)2,溶液(
 +2H++Fe2+ =VO2++Fe3++H2O)。最后用c2 mol.L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至
+2H++Fe2+ =VO2++Fe3++H2O)。最后用c2 mol.L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
您最近一年使用:0次
名校
解题方法
7 . 亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易水解生成弱酸HNO2和另一种酸,某学习小组在实验室用Cl2与NO制备ClNO并进行性质实验和纯度测定。
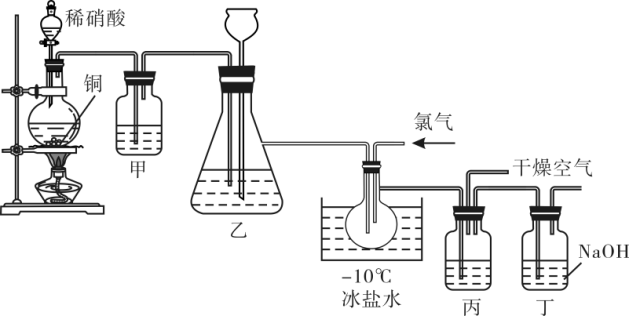
请回答下列问题:
(1)铜和稀硝酸反应开始较慢,实验室用稀硝酸和铜在加热条件下制备NO,写出离子反应方程式__________ ,若反应消耗0.8mol硝酸,转移电子数为______ 个,实验室通常在稀硝酸中滴加适量Cu(NO3)2溶液代替加热以提高速率,Cu(NO3)2的作用是________ 。
(2)洗气瓶甲中装有水,其作用是________ ,乙中的试剂是________ ,长颈漏斗的作用是_____ ,洗气瓶丙中盛放的试剂是浓硫酸,洗气瓶丙的作用是________ 。
(3)取适量ClNO水解液,滴加0.1mol·L-1KI溶液适量,有无色气体产生,很快就变红棕色,再滴加适量CCl4,振荡静置,_______ (填现象),说明HNO2具有氧化性,写出离子方程式_______ 。
(4)纯度测定:将所得亚硝酰氯(ClNO)产品2.62g溶于足量的0℃的KI溶液中,充分反应后配制成25.00mL溶液,转移至锥形瓶中,滴加几滴淀粉溶液,用1.00mol·L-1的Na2S2O3溶液滴定,反应如下: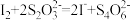 ,终点时消耗Na2S2O3溶液20.00mL,滴定终点时的现象是
,终点时消耗Na2S2O3溶液20.00mL,滴定终点时的现象是_________ ,亚硝酰氯产品的质量百分数为____ %。

请回答下列问题:
(1)铜和稀硝酸反应开始较慢,实验室用稀硝酸和铜在加热条件下制备NO,写出离子反应方程式
(2)洗气瓶甲中装有水,其作用是
(3)取适量ClNO水解液,滴加0.1mol·L-1KI溶液适量,有无色气体产生,很快就变红棕色,再滴加适量CCl4,振荡静置,
(4)纯度测定:将所得亚硝酰氯(ClNO)产品2.62g溶于足量的0℃的KI溶液中,充分反应后配制成25.00mL溶液,转移至锥形瓶中,滴加几滴淀粉溶液,用1.00mol·L-1的Na2S2O3溶液滴定,反应如下:
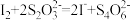 ,终点时消耗Na2S2O3溶液20.00mL,滴定终点时的现象是
,终点时消耗Na2S2O3溶液20.00mL,滴定终点时的现象是
您最近一年使用:0次
2020-09-05更新
|
183次组卷
|
2卷引用:广东省广州市第二中学2019-2020学年高二下学期期末考试化学试题
名校
解题方法
8 . 硫酸铁铵[ ]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①为碱煮水洗目的是除去废铁屑表面的油污,用文字说明碱可除油污的原因:___________ 。
(2)步骤②需要加热,温度保持 ,采用的合适加热方式是:
,采用的合适加热方式是:_______ 。铁屑中含有少量硫化物,反应产生的气体需要净化处理,最合适的装置为:_______ (填标号)。

(3)步骤③中选用足量的 ,理由是:
,理由是:_______ 。写出强酸性条件下 氧化
氧化 的离子方程式:
的离子方程式:___________ 。
(4)步骤④的化学方程式为:___________ ,步骤⑤的具体实验操作有加热浓缩、___________ 经洗涤干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水个数,将样品加热到一定温度时,失掉3个结晶水,失重11.2%,则硫酸铁铵晶体的化学式为___________
 ]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)步骤①为碱煮水洗目的是除去废铁屑表面的油污,用文字说明碱可除油污的原因:
(2)步骤②需要加热,温度保持
 ,采用的合适加热方式是:
,采用的合适加热方式是:
(3)步骤③中选用足量的
 ,理由是:
,理由是: 氧化
氧化 的离子方程式:
的离子方程式:(4)步骤④的化学方程式为:
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水个数,将样品加热到一定温度时,失掉3个结晶水,失重11.2%,则硫酸铁铵晶体的化学式为
您最近一年使用:0次
名校
9 . 亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,沸点为-5.5℃,遇水和潮气分解。回答下列问题:
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制Cl2,Cu和稀硝酸制NO。
①已知NOCl分子中所有原子最外层均满足8电子稳定结构,则NOCl的电子式为___________ 。
②制取NO的离子方程式为___________ 。
③选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口按气流方向从左至右的连接顺序为___________ 。
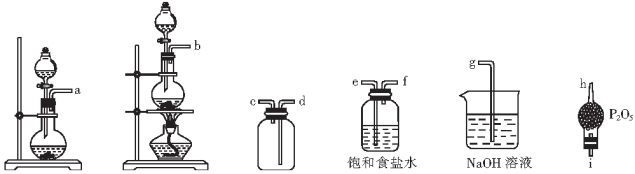
(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的装置如图所示:
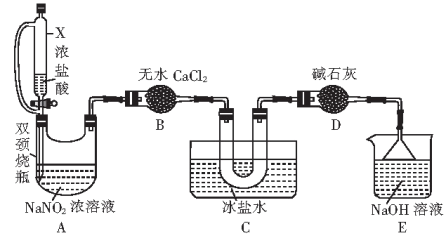
①仪器X的名称为___________ ,用它代替分液漏斗的优点是___________ 。
②装置A中制取NOCl的反应的化学方程式为___________ 。
③装置C的U形管中观察到的现象是___________ ,装置D的作用是___________ 。
(3)取少量产品NOCl滴入盛有水的试管中,液面,上方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为___________ 。
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制Cl2,Cu和稀硝酸制NO。
①已知NOCl分子中所有原子最外层均满足8电子稳定结构,则NOCl的电子式为
②制取NO的离子方程式为
③选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口按气流方向从左至右的连接顺序为

(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的装置如图所示:

①仪器X的名称为
②装置A中制取NOCl的反应的化学方程式为
③装置C的U形管中观察到的现象是
(3)取少量产品NOCl滴入盛有水的试管中,液面,上方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 2022年1月10日上午10时15分,一辆装载76桶、共计22吨硫酰氯(SO2Cl2)的箱式危化品车在杭金衢高速衢向K328处发生事故,导致4桶破损,部分硫酰氯流出,与潮湿空气接触后,现场散发出刺鼻性的烟雾,情况十分危急。硫酰氯是一种重要的化工试剂,常温下为无色液体,熔点为-54.1℃,沸点为69.1℃。如今,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如图所示(部分夹持装置未画出]:

已知:①

②100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。回答下列问题:
(1)硫酰氯(SO2Cl2)中S的化合价为_______ 。
(2)实验室常用高锰酸钾和浓盐酸来制备氯气,请写出装置A中制氯气的离子方程式_______ 。
(3)装置B盛装的试剂为_______ ;装置F的作用为_______ 。
(4)二氧化硫是合成硫酰氯的关键试剂之一,下列有关 的描述正确的是_______。
的描述正确的是_______。
(5)合成的硫酰氯在空气中不稳定,能与空气中的水蒸气生成两种常见的强酸,并产生白雾。请写出相应的化学方程式_______ 。
(6)若装置A中排出氯气4.48L(已折算成标准状况),用仪器检测到装置D中放出12kJ的热量,则氯气的转化率为_______ 。

已知:①


②100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。回答下列问题:
(1)硫酰氯(SO2Cl2)中S的化合价为
(2)实验室常用高锰酸钾和浓盐酸来制备氯气,请写出装置A中制氯气的离子方程式
(3)装置B盛装的试剂为
(4)二氧化硫是合成硫酰氯的关键试剂之一,下列有关
 的描述正确的是_______。
的描述正确的是_______。A.实验室常用稀硫酸和亚硫酸钠溶液反应来制备 |
| B.二氧化硫是一种酸性氧化物,与水反应生成硫酸,是造成酸雨的主要原因 |
| C.二氧化硫能够抑制细菌和真菌的滋生,因此,某些食品也可以用二氧化硫来防腐 |
| D.二氧化硫具有漂白性,能使湿润的蓝色石蕊试纸先变红后褪色 |
(6)若装置A中排出氯气4.48L(已折算成标准状况),用仪器检测到装置D中放出12kJ的热量,则氯气的转化率为
您最近一年使用:0次
2022-11-05更新
|
155次组卷
|
3卷引用:湘湖教育三新探索协作体2022-2023学年高二上学期11月期中联考化学试题



