名校
解题方法
1 . 用如图所示装置制取氯酸钾并进行氯气性质探究实验。
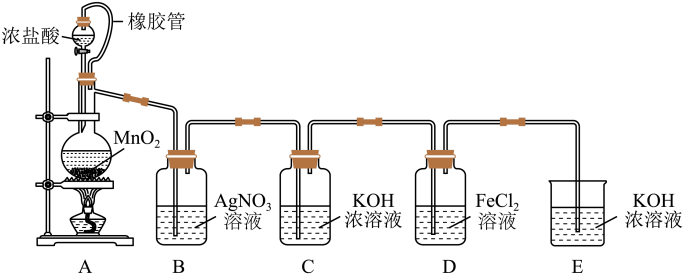
请回答下列问题:
(1)装置A中制取Cl2的化学反应方程式为___________ 。
(2)装置B中溶液出现浑浊,能否说明Cl2与AgNO3溶液发生反应?___________ (填“能”或“不能”)。请说明理由:___________ 。
(3)装置C中制取氯酸钾的化学方程式为: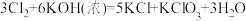 ,该反应中氧化剂为
,该反应中氧化剂为___________ ,氧化剂与还原剂个数比为___________ 。标准状况下若有67.2LCl2参与反应,则转移电子为___________ mol。
(4)装置D中导管接错,若导致FeCl2溶液进入装置E(不考虑Cl2氧化FeCl2的情况),则E中出现的现象为___________ ,涉及到的化学方程式为___________ 、___________ 。

请回答下列问题:
(1)装置A中制取Cl2的化学反应方程式为
(2)装置B中溶液出现浑浊,能否说明Cl2与AgNO3溶液发生反应?
(3)装置C中制取氯酸钾的化学方程式为:
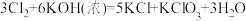 ,该反应中氧化剂为
,该反应中氧化剂为(4)装置D中导管接错,若导致FeCl2溶液进入装置E(不考虑Cl2氧化FeCl2的情况),则E中出现的现象为
您最近一年使用:0次
2 . 某学习小组通过下列装置探究 与
与 能否反应产生
能否反应产生 。
。
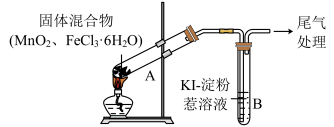
实验操作和现象:
(1)推测现象i的白雾中含有的物质是_______ (填化学式)。
(2)该小组欲探究现象ii中黄色气体的成分,实验如下:
a.加热 ,产生白雾和黄色气体。
,产生白雾和黄色气体。
b.用 溶液检验现象和实验a中的黄色气体,溶液均变红。通过该实验说明现象ii中黄色气体含有
溶液检验现象和实验a中的黄色气体,溶液均变红。通过该实验说明现象ii中黄色气体含有_______ 。
(3)除了氯气可使B中溶液变蓝外,推测还可能有其他的原因(已知 易升华)。
易升华)。
①写出 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。实验证实推测成立。
②除 与
与 外,溶液变蓝的另外一种原因是在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是
外,溶液变蓝的另外一种原因是在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是_______ 。
(4)为进一步确认黄色气体中是否含有 。
。
查阅资料:酸性条件下, 不能氧化
不能氧化 。小组同学提出两种方案,均证实了
。小组同学提出两种方案,均证实了 的存在。
的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中 —淀粉溶液替换为
—淀粉溶液替换为 溶液,检验
溶液,检验 。
。
现象如下:
①方案1的C中盛放的试剂是_______ ,其作用是_______ 。
②方案2中未检验出 的原因是
的原因是_______ 。
③综合方案1、2的现象,说明选择 溶液的依据是
溶液的依据是_______ 。
 与
与 能否反应产生
能否反应产生 。
。
实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,A中产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(2)该小组欲探究现象ii中黄色气体的成分,实验如下:
a.加热
 ,产生白雾和黄色气体。
,产生白雾和黄色气体。b.用
 溶液检验现象和实验a中的黄色气体,溶液均变红。通过该实验说明现象ii中黄色气体含有
溶液检验现象和实验a中的黄色气体,溶液均变红。通过该实验说明现象ii中黄色气体含有(3)除了氯气可使B中溶液变蓝外,推测还可能有其他的原因(已知
 易升华)。
易升华)。①写出
 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:②除
 与
与 外,溶液变蓝的另外一种原因是在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是
外,溶液变蓝的另外一种原因是在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是(4)为进一步确认黄色气体中是否含有
 。
。查阅资料:酸性条件下,
 不能氧化
不能氧化 。小组同学提出两种方案,均证实了
。小组同学提出两种方案,均证实了 的存在。
的存在。方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中
 —淀粉溶液替换为
—淀粉溶液替换为 溶液,检验
溶液,检验 。
。现象如下:
| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈浅橙红色;未检出 |
②方案2中未检验出
 的原因是
的原因是③综合方案1、2的现象,说明选择
 溶液的依据是
溶液的依据是
您最近一年使用:0次
解题方法
3 . 某兴趣小组用如图装置研究溶液的导电性,把X溶液逐滴加入含少量酚酞的 溶液中。下列说法不正确的是
溶液中。下列说法不正确的是
 溶液中。下列说法不正确的是
溶液中。下列说法不正确的是序号 | 装置 | X溶液 | 现象 |
I |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度稍微变暗 |
II |
| 溶液红色不变,有白色沉淀生成,灯泡亮度稍微变暗 | |
III |
| 溶液红色褪去,有白色沉淀生成,灯泡亮度:变暗→熄灭→变亮 |
A.实验I中溶液红色褪去,说明发生了反应 |
B.实验II中溶液红色不变,灯泡亮度稍微变暗,说明溶液中依然存在大量的 与 与 |
C.实验III中溶液红色褪去,有白色沉淀生成,灯泡由暗→灭→亮,说明发生了反应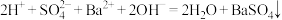 |
D.将实验II中 溶液换成 溶液换成 溶液,现象与原实验Ⅱ中的现象相同 溶液,现象与原实验Ⅱ中的现象相同 |
您最近一年使用:0次
2023-02-18更新
|
124次组卷
|
2卷引用:陕西省渭南市临渭区2022-2023学年高一上学期期末考试化学试题
名校
解题方法
4 . Al与NaOH的水溶液能反应,而镁不反应。然而一位同学将镁条放入饱和碳酸氢钠溶液时,却观察到反应迅速发生,且有大量气体放出。查阅资料显示:①镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物;②Mg与沸水能明显发生反应。为探究反应原理,同学们设计了如下实验方案并验证产物。
【实验I】:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是_______ 。
猜测2:可能是 。
。
猜测3:可能是碱式碳酸镁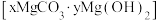 。
。
(2)设计定性实验确定产物并验证猜测:
(3)设计定量实验确定实验I的产物:称取实验I中所得干燥、纯净的白色不溶物31.0g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8g,装置B增重13.2g,试确定白色不溶物的化学式_______ 。
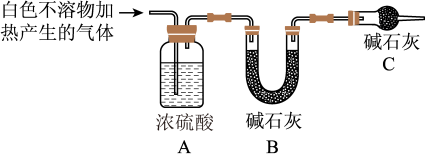
(4)根据资料显示以及实验现象,有同学认为,上述反应可能就是镁分别与水、与碳酸氢钠两个直接反应的共同结果。请你分别写出这两个可能发生的化学反应的化学方程式:_______ ,_______ 。
【实验I】:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是
猜测2:可能是
 。
。猜测3:可能是碱式碳酸镁
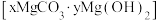 。
。(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 【实验II】 | 将实验I中收集的气体点燃 | 现象及结论 |
| 【实验III】 | 取实验I中的白色不溶物,洗涤,加入足量 |  |
| 【实验IV】 | 取实验I中的滤液,向其中加入BaCl2稀溶液 | 产生白色沉淀;溶液中存在 |

(4)根据资料显示以及实验现象,有同学认为,上述反应可能就是镁分别与水、与碳酸氢钠两个直接反应的共同结果。请你分别写出这两个可能发生的化学反应的化学方程式:
您最近一年使用:0次
2023-01-12更新
|
367次组卷
|
2卷引用:重庆市南开中学2022-2023学年高一上期期末考试化学试题
5 .  化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究
化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究 与
与 的反应机理,实验步骤如下:
的反应机理,实验步骤如下:
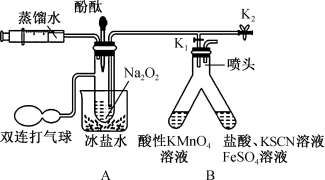
Ⅰ.打开 、
、 ,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
Ⅱ.将部分液体转移至B中;
Ⅲ.向A剩余的溶液中滴加几滴酚酞试液。
请回答下列问题:
(1)“步骤Ⅱ”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。
①将部分液体转移至B中的具体操作为_______ 。
②右侧溶液变红色的原因是_______ (用离子方程式解释)。
③左侧 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(2)若向“步骤Ⅱ”A的剩余溶液中加入 时,有大量气泡产生。
时,有大量气泡产生。
① 在该反应中的作用为
在该反应中的作用为_______ 。
②“步骤Ⅲ”的现象为_______ ;由此推测 与
与 反应的第一步为
反应的第一步为_______ (写出化学方程式)。
(3)过氧化钠可与铝粉发生反应: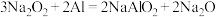 ,该反应可以体现
,该反应可以体现 具有
具有_______ (填“氧化性”、“还原性”或“既有氧化性,也有还原性”)。
 化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究
化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究 与
与 的反应机理,实验步骤如下:
的反应机理,实验步骤如下:
Ⅰ.打开
 、
、 ,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);Ⅱ.将部分液体转移至B中;
Ⅲ.向A剩余的溶液中滴加几滴酚酞试液。
请回答下列问题:
(1)“步骤Ⅱ”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。
①将部分液体转移至B中的具体操作为
②右侧溶液变红色的原因是
③左侧
 参与反应的离子方程式为
参与反应的离子方程式为(2)若向“步骤Ⅱ”A的剩余溶液中加入
 时,有大量气泡产生。
时,有大量气泡产生。①
 在该反应中的作用为
在该反应中的作用为②“步骤Ⅲ”的现象为
 与
与 反应的第一步为
反应的第一步为(3)过氧化钠可与铝粉发生反应:
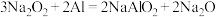 ,该反应可以体现
,该反应可以体现 具有
具有
您最近一年使用:0次
2023-01-04更新
|
772次组卷
|
3卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
解题方法
6 . SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg·L−1。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起硫酸型酸雨的罪魁祸首是大气中的SO2.它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个反应的化学方程式:_______ ;_______ 。
②酸雨可导致的危害有_______ (填序号)。
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.酸化水源、土壤等
③为了减少酸雨的形成,必须减少SO2的排放量,对化石燃料中的硫元素通常加入_______ 进行处理,并最终转化为工业用品石膏;相应的化学方程式为_______ 。
(2)某化学兴趣小组选用如图所示的实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

①若原料气从左向右流时,上述装置连接的顺序是:原料气_______ (用字母和箭头表示)。
②写出装置B中发生反应的离子方程式:_______ ;当装置B中出现_______ 现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘淀粉溶液的是_______ (填序号)。
a.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水
④若碘溶液的浓度为0.05 mol·L−1,体积为20 mL,停止通气时,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积)。那么SO2的含量是否超标?_______ 。(写计算过程)
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起硫酸型酸雨的罪魁祸首是大气中的SO2.它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个反应的化学方程式:
②酸雨可导致的危害有
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.酸化水源、土壤等
③为了减少酸雨的形成,必须减少SO2的排放量,对化石燃料中的硫元素通常加入
(2)某化学兴趣小组选用如图所示的实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

①若原料气从左向右流时,上述装置连接的顺序是:原料气
②写出装置B中发生反应的离子方程式:
③你认为下列试剂中,可以用来代替试管中的碘淀粉溶液的是
a.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水
④若碘溶液的浓度为0.05 mol·L−1,体积为20 mL,停止通气时,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积)。那么SO2的含量是否超标?
您最近一年使用:0次
解题方法
7 . 下图是实验室研究潜水艇中供氧体系反应原理的装置图(夹持仪器略)。
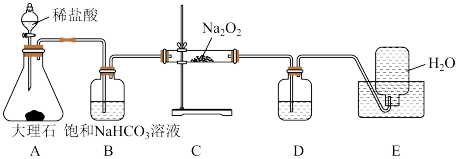
(1)A装置为CO2的发生装置,反应的离子方程式为_______ 。
(2)B装置的作用是_______ ,反应的离子方程式为_______ 。
(3)C装置为O2的发生装置,C装置硬质玻璃管中预期实验现象为:_______ ,请写出Na2O2与CO2反应的化学方程式_______ 。
(4)D装置中盛放的试剂是_______ ,作用为_______ 。

(1)A装置为CO2的发生装置,反应的离子方程式为
(2)B装置的作用是
(3)C装置为O2的发生装置,C装置硬质玻璃管中预期实验现象为:
(4)D装置中盛放的试剂是
您最近一年使用:0次
名校
解题方法
8 . 某小组探究 溶液对氯水漂白性的影响,装置如下图所示。
溶液对氯水漂白性的影响,装置如下图所示。
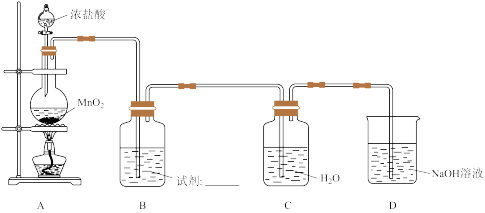
(1)A中反应的离子方程式是_______ 。
(2)B中试剂是_______ 。
(3)用化学方程式表示D中 溶液的作用
溶液的作用_______ 。
(4)取C中氯水,进行实验:向溶液a中加入 氯水。
氯水。
Ⅱ中品红褪色慢,推测可能发生了 ,导致Ⅱ中
,导致Ⅱ中 减少。分析沉淀中含
减少。分析沉淀中含 ,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。
,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。
①说明 具有
具有_______ 性。
②产生黄绿色气体的化学方程式是_______ 。
③实验发现,沉淀经几次洗涤后,加入盐酸,不再产生黄绿色气体。
(5)Ⅱ中溶液仍具有漂白性,可能是所加 溶液不足量。
溶液不足量。
①取Ⅱ中上层清液,_______ ,证实所加 溶液过量。
溶液过量。
②Ⅱ中溶液仍具有漂白性的原因是_______ 。
(6)进一步证实Ⅱ中所得沉淀中含 :向沉淀中加入饱和
:向沉淀中加入饱和 溶液,静置、过滤,滤渣、滤液备用。
溶液,静置、过滤,滤渣、滤液备用。
资料: 在一定条件下可转化为
在一定条件下可转化为
①实验证实滤渣中无 。
。
②取滤液,_______ 。
以上实验说明,所得沉淀中含 。
。
 溶液对氯水漂白性的影响,装置如下图所示。
溶液对氯水漂白性的影响,装置如下图所示。
(1)A中反应的离子方程式是
(2)B中试剂是
(3)用化学方程式表示D中
 溶液的作用
溶液的作用(4)取C中氯水,进行实验:向溶液a中加入
 氯水。
氯水。| 序号 | 溶液a | 现象 |
| Ⅰ | 1滴品红 | 几秒后品红褪色 |
| Ⅱ | 1滴品红 溶液 溶液 | 几分钟后品红褪色,产生白色沉淀 |
 ,导致Ⅱ中
,导致Ⅱ中 减少。分析沉淀中含
减少。分析沉淀中含 ,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。
,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。①说明
 具有
具有②产生黄绿色气体的化学方程式是
③实验发现,沉淀经几次洗涤后,加入盐酸,不再产生黄绿色气体。
(5)Ⅱ中溶液仍具有漂白性,可能是所加
 溶液不足量。
溶液不足量。①取Ⅱ中上层清液,
 溶液过量。
溶液过量。②Ⅱ中溶液仍具有漂白性的原因是
(6)进一步证实Ⅱ中所得沉淀中含
 :向沉淀中加入饱和
:向沉淀中加入饱和 溶液,静置、过滤,滤渣、滤液备用。
溶液,静置、过滤,滤渣、滤液备用。资料:
 在一定条件下可转化为
在一定条件下可转化为
①实验证实滤渣中无
 。
。②取滤液,
以上实验说明,所得沉淀中含
 。
。
您最近一年使用:0次
2023-01-05更新
|
746次组卷
|
2卷引用:北京市朝阳区2022-2023学年高一上学期期末统一检测化学试卷
12-13高三上·浙江温州·开学考试
9 . 下列装置能达到实验目的的是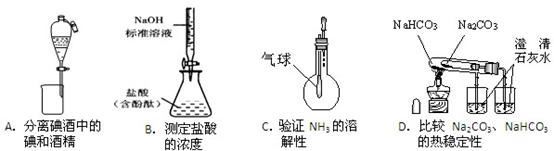

| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 现有 杂质的
杂质的 ,为测定其纯度,某同学设计了如图装置测定其杂质含量(部分夹持仪器已省略)请回答下列问题:
,为测定其纯度,某同学设计了如图装置测定其杂质含量(部分夹持仪器已省略)请回答下列问题:
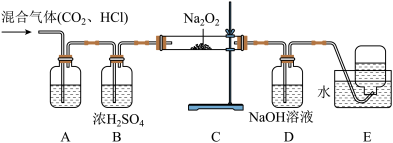
Ⅰ、
(1)取少量含有 杂质的
杂质的 样品于试管中,加水溶解后加入酚酞,振荡,现象是
样品于试管中,加水溶解后加入酚酞,振荡,现象是___________ 。
(2)装置A的作用除去 中的
中的 气体,A中不能用饱和碳酸钠溶液的原因是
气体,A中不能用饱和碳酸钠溶液的原因是___________ (用化学反应方程式表示)。
(3)装置D中 溶液的作用是
溶液的作用是___________ ,若无装置D,样品中 的质量分数
的质量分数___________ (填“偏高”、“偏低”、“无影响”)
(4)取 样品于C中完全反应,实验结束后测得E中收集到的气体体积为
样品于C中完全反应,实验结束后测得E中收集到的气体体积为 ,已知该气体的密度为
,已知该气体的密度为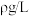 ,则样品中
,则样品中 的质量分数为
的质量分数为___________ 。(用含有 的数值表示)
的数值表示)
Ⅱ、检验装置C的成分
(5)为了确定反应后装置C硬质玻璃管中固体的成分,甲同学做出了以下的猜想并设计实验验正。
猜想一: ,猜想二:
,猜想二: ,稍想三:
,稍想三: 和
和
限选试剂:稀盐酸、 溶液、
溶液、 溶液、
溶液、 溶液
溶液
实验结论:猜想三成立。
 杂质的
杂质的 ,为测定其纯度,某同学设计了如图装置测定其杂质含量(部分夹持仪器已省略)请回答下列问题:
,为测定其纯度,某同学设计了如图装置测定其杂质含量(部分夹持仪器已省略)请回答下列问题:
Ⅰ、
(1)取少量含有
 杂质的
杂质的 样品于试管中,加水溶解后加入酚酞,振荡,现象是
样品于试管中,加水溶解后加入酚酞,振荡,现象是(2)装置A的作用除去
 中的
中的 气体,A中不能用饱和碳酸钠溶液的原因是
气体,A中不能用饱和碳酸钠溶液的原因是(3)装置D中
 溶液的作用是
溶液的作用是 的质量分数
的质量分数(4)取
 样品于C中完全反应,实验结束后测得E中收集到的气体体积为
样品于C中完全反应,实验结束后测得E中收集到的气体体积为 ,已知该气体的密度为
,已知该气体的密度为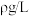 ,则样品中
,则样品中 的质量分数为
的质量分数为 的数值表示)
的数值表示)Ⅱ、检验装置C的成分
(5)为了确定反应后装置C硬质玻璃管中固体的成分,甲同学做出了以下的猜想并设计实验验正。
猜想一:
 ,猜想二:
,猜想二: ,稍想三:
,稍想三: 和
和
限选试剂:稀盐酸、
 溶液、
溶液、 溶液、
溶液、 溶液
溶液| 步骤 | 操作 | 现象 |
| Ⅰ | 取少量C中的固体于试管中,加入蒸馏水溶解,并加入足量试剂 | 产生白色沉淀 |
| Ⅱ | 静置,过滤,取上层清液,加入试剂 |
您最近一年使用:0次


 溶液
溶液 溶液
溶液

