解题方法
1 . 尿素还原法合成溴化锂,设备简单、产品质量好、无有毒气体排放、生产成本低。下图是制备无水溴化锂的工艺路线:
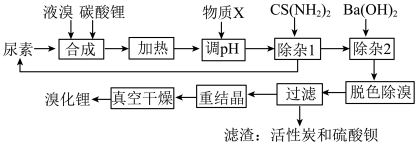
回答下列问题:
(1)Br位于周期表第________ 周期________ 族。
(2)常用焰色试验鉴别碳酸锂,火焰呈现________ 色。
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因________ 。
(4)合成溴化锂的主要化学方程式________ 。
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为________ 。
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是________ 。
(7)重结晶的操作为________ 。

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
碳酸锂溶解度(g) | 1.51 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)Br位于周期表第
(2)常用焰色试验鉴别碳酸锂,火焰呈现
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因
(4)合成溴化锂的主要化学方程式
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是
(7)重结晶的操作为
您最近一年使用:0次
2024-04-02更新
|
353次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
名校
解题方法
2 . 某小组设计实验探究 和浓盐酸反应的最低浓度以及氯气的性质,实验装置如图所示。
和浓盐酸反应的最低浓度以及氯气的性质,实验装置如图所示。
回答下列问题:
(1)装置B中试剂是________ (填名称),装置E的作用是____________ 。
(2)装置A中反应的离子方程式为______________ 。
(3)能证明氯的非金属性比硫强的实验现象是___________ 。经检验装置C中最终生成了 ,写出C中浑浊变澄清时反应的化学方程式:
,写出C中浑浊变澄清时反应的化学方程式:____________ 。
(4)根据装置D中现象,有人认为 被氧化了。请你设计实验证明他的观点是否正确:
被氧化了。请你设计实验证明他的观点是否正确:____________ 。
(5)实验完毕后,利用下列装置测定装置A中剩余盐酸的浓度:
将装置A中剩余溶液过滤,取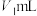 滤液进行实验,最终收集
滤液进行实验,最终收集 的体积为
的体积为 (已折合成标准状况)。
(已折合成标准状况)。
a.读数 b.冷却至室温 c.调平量气管和烧杯的液面
正确操作步骤的顺序为________ (填字母)。
②能与 反应的最低盐酸浓度为
反应的最低盐酸浓度为________  (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
 和浓盐酸反应的最低浓度以及氯气的性质,实验装置如图所示。
和浓盐酸反应的最低浓度以及氯气的性质,实验装置如图所示。
回答下列问题:
(1)装置B中试剂是
(2)装置A中反应的离子方程式为
(3)能证明氯的非金属性比硫强的实验现象是
 ,写出C中浑浊变澄清时反应的化学方程式:
,写出C中浑浊变澄清时反应的化学方程式:(4)根据装置D中现象,有人认为
 被氧化了。请你设计实验证明他的观点是否正确:
被氧化了。请你设计实验证明他的观点是否正确:(5)实验完毕后,利用下列装置测定装置A中剩余盐酸的浓度:
将装置A中剩余溶液过滤,取
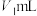 滤液进行实验,最终收集
滤液进行实验,最终收集 的体积为
的体积为 (已折合成标准状况)。
(已折合成标准状况)。
a.读数 b.冷却至室温 c.调平量气管和烧杯的液面
正确操作步骤的顺序为
②能与
 反应的最低盐酸浓度为
反应的最低盐酸浓度为 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-04-04更新
|
634次组卷
|
5卷引用:河南省濮阳市2024届高三下学期第二次模拟考试理科综合化学试题
河南省濮阳市2024届高三下学期第二次模拟考试理科综合化学试题河南省濮阳市2024届高三第一次模拟考试理综-化学试题山西省晋中市2024届高三第二次优生测试理综合化学试题-(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)2024届河南省鹤壁市高中高三下学期模拟预测化学试题
3 . 银及其化合物在制造钱币、电子工业、医药等方面具有广泛用途。
Ⅰ.银的冶炼及性质
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为__ 。
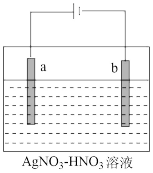
(2)电解精炼银的工作原理如图所示,___ (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为___ 。
Ⅱ.银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__ 。
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为__ 。
(5)纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式__ 。
Ⅰ.银的冶炼及性质
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为
(2)电解精炼银的工作原理如图所示,

Ⅱ.银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为
(5)纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式
您最近一年使用:0次
2021-05-03更新
|
598次组卷
|
4卷引用:北京市丰台区2021届高三第二次模拟考试化学试题
北京市丰台区2021届高三第二次模拟考试化学试题(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)北京市第三中学2021-2022学年高三上学期期中考试化学试题



