解题方法
1 . 目前,中国空间站组合体在轨稳定运行,神舟十五号航天员乘组状态良好,计划于今年6月返回地面。制作航天服所用的涤纶通常由对苯二甲酸和乙二醇反应生成。爱好航天的小明设计了由乙醇合成乙二醇的路线如下图所示。请利用本学期所学知识回答下列问题:
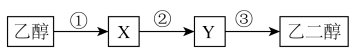
(1)X是_______ (填名称)。
(2)请写出X→Y的化学方程式:_______ 。
(3)步骤③的反应条件应为_______ ,请写出Y→乙二醇的化学方程式:_______ ,该反应的反应类型为_______ 。

(1)X是
(2)请写出X→Y的化学方程式:
(3)步骤③的反应条件应为
您最近一年使用:0次
名校
2 . 某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线
CH3CH=CH2+CO+H2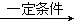 CH3CH2CH2CHO
CH3CH2CH2CHO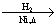 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO 的制备原理:HCOOH CO↑+H2O。
CO↑+H2O。
(1)正丁醛经催化加氢得到含少量正丁醛的 1-丁醇粗品。为纯化 1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) →RCH(OH)SO3Na↓;
②沸点:乙醚 34℃,1-丁醇 118℃,并设计出如下提纯路线:

试剂1为____________ ,操作3为____________ 。
(2)原料气CH3CH=CH2、CO和H2的制备装置图设计如下:
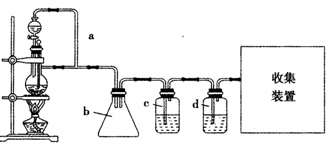

填写下列空白:
①若用左图装置制备干燥纯净的CO气体,装置a的作用是__________ ;c中盛装的试剂是____________ 。
②若用右图装置制备CO,收集装置可选用装置____________ 。
③实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯,写出反应的化学方程式:_____________________ 。 制丙烯时,产生的气体除了丙烯及水蒸气外,还存在CO2、SO2;为检验这四种气体,下列装置按气流方向的连接顺序为_______________________ 各药品最多只能用1次)。

CH3CH=CH2+CO+H2
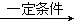 CH3CH2CH2CHO
CH3CH2CH2CHO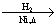 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH已知:CO 的制备原理:HCOOH
 CO↑+H2O。
CO↑+H2O。(1)正丁醛经催化加氢得到含少量正丁醛的 1-丁醇粗品。为纯化 1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) →RCH(OH)SO3Na↓;
②沸点:乙醚 34℃,1-丁醇 118℃,并设计出如下提纯路线:

试剂1为
(2)原料气CH3CH=CH2、CO和H2的制备装置图设计如下:


填写下列空白:
①若用左图装置制备干燥纯净的CO气体,装置a的作用是
②若用右图装置制备CO,收集装置可选用装置
③实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯,写出反应的化学方程式:

您最近一年使用:0次
2016-12-09更新
|
413次组卷
|
2卷引用:【全国校级联考】辽宁省沈阳市第五中学、同泽高级中学2017-2018学年高一下学期期中联合考试化学试题
名校
3 . 以环戊烷为原料制备环戊二烯的合成路线如下,下列说法错误的是
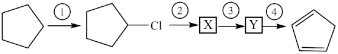
A.X的结构简式为 |
| B.反应④的反应试剂和反应条件是浓硫酸、加热 |
| C.环戊二烯分子中所有碳原子一定在同一平面内 |
D.环戊二烯与Br以物质的量之比为1:1反应,可生成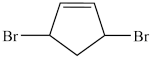 |
您最近一年使用:0次
2022-07-12更新
|
365次组卷
|
6卷引用:辽宁省锦州市2021-2022学年高二下学期期末考试化学试卷
辽宁省锦州市2021-2022学年高二下学期期末考试化学试卷云南省大理市下关第一中学2022-2023学年高二上学期段考(二)化学(B卷)试题(已下线)3.5.2有机合成路线的设计与实施(巩固)(已下线)3.5.1有机合成的主要任务(基础)(已下线)题型04 有机推断与合成-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)(已下线)专题05 有机反应类型与有机合成 -备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
名校
解题方法
4 . 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G,以A为原料的合成路线如下图所示。
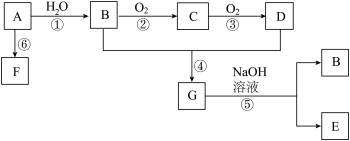
回答下列问题:
(1)D、G分子中的官能团名称分别__________ 、__________ 。
(2)在反应①~⑥中,属于加成反应的是______ ,属于取代反应的是_____ 。(填序号)
(3)写出与G分子式相同的所有羧酸类的同分异构体:_________________
(4)写出由C与新制氢氧化铜反应的化学方程式:_________________

回答下列问题:
(1)D、G分子中的官能团名称分别
(2)在反应①~⑥中,属于加成反应的是
(3)写出与G分子式相同的所有羧酸类的同分异构体:
(4)写出由C与新制氢氧化铜反应的化学方程式:
您最近一年使用:0次
2020-04-27更新
|
324次组卷
|
2卷引用:辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题
5 . 工业上以煤、石油和天然气为原料,生产三大合成材料——塑料、合成橡胶和合成纤维。下列有关说法错误的是
| A.塑料、合成橡胶和合成纤维属于有机高分子材料 |
| B.蚕丝、涤纶、尼龙都属于合成纤维 |
| C.石油裂解得到的乙烯、丙烯等是生产合成材料的基本原料 |
| D.高分子材料可分为天然高分子材料和合成高分子材料两大类 |
您最近一年使用:0次
2023-05-28更新
|
243次组卷
|
5卷引用:辽宁省凌源市普通高中2022-2023学年高一下学期期中考试化学试题
6 . “碳中和”是指 的排放总量和减少总量相当。下列措施中不能有效地促进“碳中和”的是
的排放总量和减少总量相当。下列措施中不能有效地促进“碳中和”的是
 的排放总量和减少总量相当。下列措施中不能有效地促进“碳中和”的是
的排放总量和减少总量相当。下列措施中不能有效地促进“碳中和”的是| A.发展太阳能、风力发电 | B.开采可燃冰作为新能源 |
| C.提倡使用氢气燃料 | D.以 为原料合成 为原料合成 |
您最近一年使用:0次
2022-04-10更新
|
260次组卷
|
2卷引用:辽宁省普通高等学校招生2022届高三选择性模拟考试(一)化学试题
2010·四川绵阳·一模
7 . 2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。
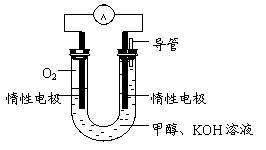
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。

②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
您最近一年使用:0次
2019-01-30更新
|
749次组卷
|
4卷引用:辽宁省大连市2020届高三上学期第三次模拟考试理综化学试题
辽宁省大连市2020届高三上学期第三次模拟考试理综化学试题(已下线)2010年四川绵阳高考预测(综合题)化学卷(已下线)2010-2011学年广东省陆丰市龙山中学高二下学期5月月考(理综)化学试题吉林省四平市双辽市第二中学2019-2020学年高三上学期期末考试化学试题



