1 . 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.32g甲醇中含有C-H键的数目为4NA |
| B.1 molFe溶于过量稀硫酸,转移的电子数目为3NA |
| C.0.1 mol·L- 1H2S溶液中含有阳离子总数为0.2 NA |
| D.标准状况下,22.4LN2和O2混合气中含有的原子数为2NA |
您最近一年使用:0次
真题
名校
2 . 葡萄酒中含有CH3CH2OH、CH3COOH、 SO2 和CO2等多种成分。若NA代表阿伏加德罗常数的值,下列说法正确的是
| A.46gCH3CH2OH中含有C-H键数为5NA |
| B.1L1 mol·L-1CH3COOH溶液中含有氢离子数为NA |
| C.1 mol SO2与1 mol O2完全反应转移的电子数为4 NA |
| D.11.2L (标准状况) CO2完全溶于水后溶液中H2CO3分子数为0.5NA |
您最近一年使用:0次
2022-05-27更新
|
3215次组卷
|
4卷引用:第8讲 物质的量与气体摩尔体积
(已下线)第8讲 物质的量与气体摩尔体积(已下线)题型02 阿伏加德罗常数的判断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)重庆市2021年高考真题化学试题河北省昌黎第一中学2023届高三下学期开学考试化学试题
名校
解题方法
3 . 在碱性镀铜中电镀液的主要成分是 ,其内界的电离与弱电解质类似,仅部分解离为中心离子和配位体。设NA为阿伏加德罗常数的值,下列说法正确的是
,其内界的电离与弱电解质类似,仅部分解离为中心离子和配位体。设NA为阿伏加德罗常数的值,下列说法正确的是
 ,其内界的电离与弱电解质类似,仅部分解离为中心离子和配位体。设NA为阿伏加德罗常数的值,下列说法正确的是
,其内界的电离与弱电解质类似,仅部分解离为中心离子和配位体。设NA为阿伏加德罗常数的值,下列说法正确的是A.1mol/L 溶液中 溶液中 数目小于NA 数目小于NA |
| B.22.4LNH3含有的质子数目为10NA |
C.1mol 的配位键数目为2NA 的配位键数目为2NA |
| D.N2和H2合成1molNH3转移电子数目为3NA |
您最近一年使用:0次
2023-07-25更新
|
1253次组卷
|
8卷引用:第9讲 物质的量浓度
(已下线)第9讲 物质的量浓度(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)第20讲化学键(已下线)阿伏伽德罗常数的应用湖南省衡阳市名校协作体2023届高三第三次模拟考试化学试题江西省吉安市宁冈中学2023-2024学年高三上学期开学考试化学试题 福建省龙岩第一中学2023-2024学年高三上学期第三次月考化学试题湖南省长沙市第一中学2023-2024学年高三下学期2月自主检测化学试题
4 . CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
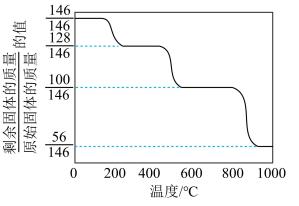
①写出400~600 ℃范围内分解反应的化学方程式:________ 。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________ 。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:________ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________ 。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
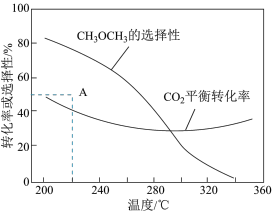
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
CH3OCH3的选择性=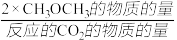 ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________ 。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________ 。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=
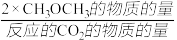 ×100%
×100%①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
您最近一年使用:0次
2019-06-10更新
|
6314次组卷
|
7卷引用:专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习
(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)原理综合题2019年江苏省高考化学试题北京市朝阳区第八十中学2020届高三模拟化学试题鲁科版(2019)选择性必修1 模块复习备考攻略人教版(2019)高二选择性必修第一册 模块复习备考攻略湖北省石首一中2020-2021学年高三上学期11月月考化学试题
5 . NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温下,1LpH=12的NaOH溶液中由水电离出的OH-数目为10-12NA |
| B.5.6gFe分别与足量的Cl2和S反应,转移电子数目均为0.3NA |
| C.标准状况下,11.2L氯仿(CHCl3)中含有分子数目为0.5NA |
| D.常温常压下,12g14C所含的质子数为6NA |
您最近一年使用:0次
名校
解题方法
6 . 硫酸亚铁铵晶体,又称摩尔盐,是分析化学中重要的基准物质,其化学式可表示为
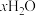 。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
已知:①
②摩尔盐在580℃下完全分解,得到红棕色固体
则下列说法正确的是


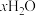 。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。已知:①

②摩尔盐在580℃下完全分解,得到红棕色固体
则下列说法正确的是

A.用 溶液检验摩尔盐中的金属阳离子 溶液检验摩尔盐中的金属阳离子 |
B. |
| C.用湿润的红色石蕊试纸检验205~420℃间分解产生的气体,试纸变蓝 |
D.0~580℃发生的化学方程式为: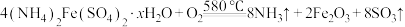 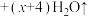 |
您最近一年使用:0次
2023-02-09更新
|
1168次组卷
|
3卷引用:专题卷08 无机物的性质与用途-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
(已下线)专题卷08 无机物的性质与用途-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)重庆市南开中学校2023届高三下学期第六次质量检测化学试题黑龙江省大庆铁人中学2023-2024学年高一下学期开学考试化学试题
7 . 铅丹( )可用作防锈涂料,它与浓盐酸反应的化学方程式为:
)可用作防锈涂料,它与浓盐酸反应的化学方程式为: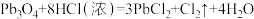 。设
。设 为阿伏伽德罗常数值。下列说法不正确的是
为阿伏伽德罗常数值。下列说法不正确的是
 )可用作防锈涂料,它与浓盐酸反应的化学方程式为:
)可用作防锈涂料,它与浓盐酸反应的化学方程式为: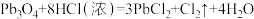 。设
。设 为阿伏伽德罗常数值。下列说法不正确的是
为阿伏伽德罗常数值。下列说法不正确的是A.标准状况下,22.4L  溶于水所得溶液中含HClO分子数为 溶于水所得溶液中含HClO分子数为 |
B.1L 12 的浓盐酸与足量 的浓盐酸与足量 反应生成的 反应生成的 分子数少于1.5 分子数少于1.5 |
C.标准状况下,22.4L  中,含有H原子数目大于2 中,含有H原子数目大于2 |
D.反应中消耗137g  ,转移的电子数目为0.4 ,转移的电子数目为0.4 |
您最近一年使用:0次
2023-05-13更新
|
1061次组卷
|
7卷引用:T5-阿伏伽德罗常数
(已下线)T5-阿伏伽德罗常数(已下线)专题03 阿伏伽德罗常数的应用(已下线)第8讲 物质的量与气体摩尔体积(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)重庆市2023届高三下学期5月“三诊”化学试题北京市第二十中学2023-2024学年高三上学期10月月考化学试题重庆市荣昌中学校2023-2024学年高三上学期12月月考化学试题
名校
8 . 设阿伏加德罗常数的值为 ,则下列说法正确的是
,则下列说法正确的是
 ,则下列说法正确的是
,则下列说法正确的是A.常温常压下,22g 气体中含有的原子数为 气体中含有的原子数为 |
B.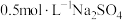 溶液中,含有的钠离子总数为 溶液中,含有的钠离子总数为 |
C.2.3g钠由原子变成离子时,失去的电子数为0.1 |
D. 个一氧化碳分子和0.5mol甲烷的原子个数比为5∶4 个一氧化碳分子和0.5mol甲烷的原子个数比为5∶4 |
您最近一年使用:0次
2022-06-30更新
|
1216次组卷
|
6卷引用:第17讲 物质的量在化学方程式计算中的应用(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )
(已下线)第17讲 物质的量在化学方程式计算中的应用(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )广西柳州市2021-2022学年高一下学期期末联考化学试题吉林省长春市第五中学2021-2022学年高二下学期期末考试化学试题(已下线)铁 金属材料——进阶学习黑龙江省富锦市第一中学2022-2023学年高一上学期期末考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题
9 . 设NA为阿伏加德罗常数的值。下列说法正确的是
A.4MnO +5HCHO+12H+=4Mn2++5CO2↑+11H2O,生成5molCO2转移的电子数为20NA +5HCHO+12H+=4Mn2++5CO2↑+11H2O,生成5molCO2转移的电子数为20NA |
| B.用电解精铜的方法精炼铜,当电路中通过的电子数为NA时,阳极质量减少为32g |
| C.常温下,pH=9的CH3COONa溶液中,水电离出的H+数为10-5NA |
| D.常温常压下,5.6LF2和C2H6的混合物中含有电子的数目为4.5NA |
您最近一年使用:0次
2022-03-01更新
|
1193次组卷
|
7卷引用:卷11 溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)
(已下线)卷11 溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)专项03 化学计量-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)专题02 阿伏伽德罗常数的判断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)陕西省渭南市2022届高考第一次模拟考试化学试题陕西省渭南市2021-2022学年高三下学期第一次模拟考试化学试题新疆喀什地区岳普湖县2021-2022学年高三下学期第一次模拟考试化学试题(已下线)化学-2022年高考考前押题密卷(湖北卷)
名校
10 . 回答下列问题
(1)0.5mol水中含有___________ 个水分子;9g水与___________ g硫酸所含的分子数相等。
(2)100mL0.2mol/LNa2SO4溶液中Na+的物质的量浓度为___________ 。
(3)标准状况下,和2molNH3含有相同氢原子数的CH4的体积为___________ 。
(4)从1LAl2(SO4)3溶液中取出100mL,向其中加入200mL0.9mol·L-1的BaCl2溶液恰好使SO 完全沉淀,则原溶液中Al3+的物质的量浓度为
完全沉淀,则原溶液中Al3+的物质的量浓度为___________ 。
(5)12.4gNa2R含0.4molNa+,则Na2R的摩尔质量为___________ ,R的相对原子质量为___________ 。
(6)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是___________ 。
(1)0.5mol水中含有
(2)100mL0.2mol/LNa2SO4溶液中Na+的物质的量浓度为
(3)标准状况下,和2molNH3含有相同氢原子数的CH4的体积为
(4)从1LAl2(SO4)3溶液中取出100mL,向其中加入200mL0.9mol·L-1的BaCl2溶液恰好使SO
 完全沉淀,则原溶液中Al3+的物质的量浓度为
完全沉淀,则原溶液中Al3+的物质的量浓度为(5)12.4gNa2R含0.4molNa+,则Na2R的摩尔质量为
(6)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是
您最近一年使用:0次



