11-12高一上·江西宜春·期中
名校
解题方法
1 . a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为
A.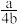 mol-1 mol-1 | B.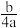 mol-1 mol-1 | C.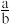 mol-1 mol-1 | D. mol-1 mol-1 |
您最近一年使用:0次
2021-10-19更新
|
3188次组卷
|
82卷引用:夯基提能2020届高三化学选择题对题专练——溶解度、质量分数的相关计算
夯基提能2020届高三化学选择题对题专练——溶解度、质量分数的相关计算(已下线)衔接点18 物质的量-2022年初升高化学无忧衔接?(已下线)2011-2012学年江西省高安中学高一上学期期中考试化学试卷(已下线)2011—2012学年福建省漳州市芗城中学高一上学期期中考试化学试卷(已下线)2012年人教版高中化学必修一1.2 化学计量在实验中的应用练习卷(已下线)2014-2015学年河南省武涉县一中西区高一9月月考化学试卷2015-2016学年山西省太原五中高一上第一次月考化学试卷2016-2017学年湖北沙市中学高一上第一次双周练化学卷2016-2017学年内蒙古赤峰二中高一上9月月考化学试卷2016-2017学年山东省菏泽市高一上学期期中化学试卷甘肃省武威市第二中学2016-2017学年高二下学期期末考试化学试题(已下线)1.2.1 物质的量的单位—摩尔湖北省沙市中学2017-2018学年高一上学期第二次双周考化学试题河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第一次月考化学试题陕西省西安电子科技中学2017-2018学年高一上学期第一次月考化学试题贵州省大方县第一中学2017-2018学年高一上学期第一次月考化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高一10月月考化学试题江西省赣州厚德外国语学校2017-2018学年高一上学期期中考试化学试题高中化学人教版 必修1 第一章 从实验学化学 2.化学计量在实验中的应用 物质的量的单位——摩尔湖南辰溪博雅实验学校2018-2019学年高一上学期8月月考化学试题云南省曲靖市会泽县一中2018-2019学年高一上学期第一次半月考化学试题四川省邻水实验学校2018-2019学年高一上学期第一次月考化学试题四川省成都市新津中学2018-2019学年高一上学期9月月考化学试题【全国百强校】辽宁省葫芦岛市第一高级中学2018-2019学年高一上学期第一次月考理科综合化学试题河南省安阳市第三十六中学2018-2019学年高一上学期第一次月考化学试题鲁科版(2019)新教材同步1.3.1物质的量及其单位—摩尔质量 练习2019-2020学年高一上学期期中考试模拟试题(A)第1章《走进化学科学》期中复习检测试卷甘肃省甘谷第一中学2019-2020学年高一上学期第一次月考化学试题黑龙江省大庆市第一中学2019-2020学年高一上学期第一次月考化学试题云南省鲁甸县一中2019-2020学年高一10月月考化学试题云南省文山壮族苗族自治州马关县第一中学校2019-2020学年高一上学期10月月考化学试题甘肃省兰州市第五十五中学2019-2020学年高一上学期12月月考化学试题山东省枣庄市滕州市第一中学2019-2020学年高一上学期10月月考化学试题广东省深圳市南山区南山外国语学校(集团)高级中学2019-2020学年高一上学期期中考试化学试题云南省通海三中2019-2020学年高一上学期期末考试化学试题甘肃省庆阳市宁县第二中学2019-2020学年高一上学期第一次月考化学试题云南省曲靖市陆良县第十中学2019-2020学年高一上学期期末考试化学试题(已下线)【新东方】2002-36(已下线)【新东方】高中化学 B1(已下线)【新东方】高中化学 B2(已下线)1.2.1 物质的量 摩尔质量练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)1.3.1 物质的量及其单位—摩尔 摩尔质量练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)苏教版(2020)高一必修第一册专题1第二单元 课时1 物质的量人教版(2019)高一必修第一册第二章 海水中的重要元素 第三节 物质的量 课时1 物质的量的单位——摩尔人教版(2019)高一必修第一册 第二章 第三节课时1 物质的量鲁科版(2019)高一必修第一册第1章 认识化学科学 第3节 物质的量 课时1 物质的量 摩尔质量鲁科版(2019)高一必修第一册第一章第3节 化学中常用的物理量——物质的量 课时1 物质的量及其单位——摩尔高一必修第一册(苏教2019版)专题1 第二单元 物质的化学计量 课时1 物质的量山东省菏泽市单县第五中学2020-2021学年高一上学期第一次月考(10月)化学(希望班)试题(已下线)第一章 认识化学科学(能力提升)-2020-2021学年高一化学上学期必修第一册《单元测试定心卷》 (鲁科版2019)(已下线)【南昌新东方】16. 九江同文中学 袁裕虎广西钦州市第四中学2020-2021学年高一10月月考化学试题(已下线)2.3.1 物质的量的单位---摩尔(精练)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)黑龙江省哈尔滨师范大学附属中学2020-2021学年高一上学期期中考试化学试题甘肃省武威第十八中学2020-2021学年高一上学期期中考试化学试题安徽省淮北市树人高级中学2020-2021学年高一上学期第一次阶段考试化学试题山西省临汾市县底中学校2020-2021学年高一上学期开学考试化学试题辽宁省大连市普兰店区第一中学2020-2021学年高一上学期第二阶段考试化学试题(已下线)1.2.1 物质的量(1)(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)福建省福州金山中学2021-2022学年高一上学期10月月考化学试题宁夏海原第一中学2021-2022学年高一上学期第一次月考化学试题河南省南阳市南召现代中学2021-2022学年高一上学期第一次月考化学试题福建省泉州鲤城北大培文学校2021-2022学年高一上学期10月月考化学试题上海市徐汇中学2021-2022学年高一上学期10月月考化学试题湖北省宜昌市第一中学2021-2022学年高一上学期期中考试化学试题四川省内江市威远中学2021-2022学年高一上学期期中考试化学试题河南省濮阳市油田第二高级中学2021-2022学年高一上学期诊断性测试化学试题课前-1.3.1物质的量及其单位—摩尔 摩尔质量(课前)-鲁科版2019必修第一册第三节 物质的量 第1课时 物质的量的单位——摩尔上海市上海师范大学附属嘉定高级中学2021-2022学年高一上学期期中考试化学试题山东省德州市第一中学2022-2023学年高一10月月考化学试题安徽省亳州市第二完全中学2022-2023学年高一上学期期中教学质量检测化学试题湖南省常德市第二中学2021-2022学年高一下学期入学考试化学试题上海中学东校2022学年高一上学期学期素质评估化学试题第1课时 物质的量 摩尔质量河北省张家口市宣化第一中学2022-2023学年高一上学期12月月考化学试题山东省实验中学2023-2024学年高一上学期10月月考化学试题河北省衡水市安平中学2023-2024学年高一上学期第一次月考化学试题河北省唐县第一中学2023-2024学年高一上学期10月月考化学试题内蒙古自治区赤峰四中2021-2022学年高一上学期第一次月考化学试题河北省石家庄市西山学校2022-2023学年高一上学期期中考试化学试题
2 . 用 表示阿伏加德罗常数的值,,下列有关叙述错误的是
表示阿伏加德罗常数的值,,下列有关叙述错误的是
 表示阿伏加德罗常数的值,,下列有关叙述错误的是
表示阿伏加德罗常数的值,,下列有关叙述错误的是| A.含有3molC-C键的石墨中含有的碳原子数为2 NA |
B.标准状况下,22.4L 与22.4L 与22.4L 充分反应,生成的气体分子数大于NA 充分反应,生成的气体分子数大于NA |
| C.分别向含0.1mol氯化铁的溶液中加入足量镁粉和铜粉,转移的电子数目均为0.1 NA |
D.用铅蓄电池电解氯化钠溶液,当消耗4mol硫酸时,产生 分子数目为2NA 分子数目为2NA |
您最近一年使用:0次
2022-05-24更新
|
1163次组卷
|
3卷引用:第01讲 物质的量 气体摩尔体积(讲)-2023年高考化学一轮复习讲练测(全国通用)
(已下线)第01讲 物质的量 气体摩尔体积(讲)-2023年高考化学一轮复习讲练测(全国通用)河北省石家庄市第二中学2022届高三下学期5月模拟考试化学试题天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题
3 . 请回答下列问题:
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为_______
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为_______
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为_______
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为_______
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是_______
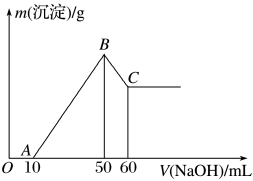
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为_______
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为

您最近一年使用:0次
2022-04-04更新
|
1306次组卷
|
3卷引用:专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)
(已下线)专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题
4 . 水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
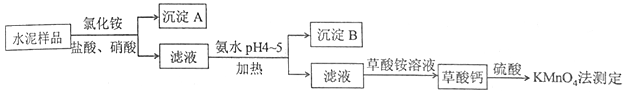
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是________________________________________ ,还可使用___________ 代替硝酸。
(2)沉淀A的主要成分是_________ ,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________ 。
(3)加氨水过程中加热的目的是______________________________________ 。沉淀B的主要成分为_____________ 、____________ (填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4-+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________ 。

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是
(2)沉淀A的主要成分是
(3)加氨水过程中加热的目的是
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO4-+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为
您最近一年使用:0次
2017-08-08更新
|
9848次组卷
|
25卷引用:《考前20天终极攻略》-5月28日 工艺流程分析
(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第5讲 无机框图题的解答策略【教学案】百所名校联考-非金属及其化合物(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)专题四 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向10 碳、硅及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)第11讲 碳、硅及无机非金属材料(练)-2023年高考化学一轮复习讲练测(全国通用)第四章 非金属及其化合物 第17讲 无机非金属材料2017年全国普通高等学校招生统一考试理综化学(新课标Ⅱ卷精编版)重庆市第二中学2018届高三3月测试化学试题西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题陕西省吴起高级中学2019届高三上学期期中考试化学试题安徽省亳州市第二中学2018-2019学年高二下学期期中考试化学试题云南省漾濞二中2020届高三上学期开学考试化学试题贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题福建省福州第一中学2021届高三上学期期中考试化学试题宁夏石嘴山市第三中学2021届高三上学期第二次月考化学试题福建省长泰县第一中学2021届高三上学期11月考试化学试题云南省保山第九中学2021届高三上学期开学考试化学试题广东省广州市禺山高级中学2020-2021学年高二下学期第一阶段考试化学试题黑龙江省哈尔滨市第三中学2021-2022学年上学期高三第三次验收考试化学试题广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题
真题
名校
5 .  为阿伏伽德罗常数的值。下列说法正确的是
为阿伏伽德罗常数的值。下列说法正确的是
 为阿伏伽德罗常数的值。下列说法正确的是
为阿伏伽德罗常数的值。下列说法正确的是A.0.1 mol 的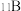 中,含有 中,含有 个中子 个中子 |
B.pH=1的H3PO4溶液中,含有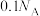 个 个 |
C.2.24L(标准状况)苯在O2中完全燃烧,得到 个CO2分子 个CO2分子 |
D.密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加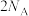 个P-Cl键 个P-Cl键 |
您最近一年使用:0次
2017-08-08更新
|
10740次组卷
|
36卷引用:【中等生百日捷进提升系列-技能方法】专题03 阿伏加德罗常数类选择题解题方法和策略
(已下线)【中等生百日捷进提升系列-技能方法】专题03 阿伏加德罗常数类选择题解题方法和策略(已下线)《考前20天终极攻略》-5月17日 阿伏加德罗常数的相关判断与计算(已下线)解密02 化学常用计量——备战2018年高考化学之高频考点解密(已下线)学科网2019年高考化学一轮复习讲练测1.1 物质的量 气体摩尔体积 练(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第1讲 物质的量、气体摩尔体积【教学案】(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第1讲 物质的量 气体摩尔体积 (教学案)(已下线)2019高考备考二轮复习精品资料-专题2 化学常用计量(教学案)(已下线)2019年高考总复习巅峰冲刺-专题02 阿佛加德罗常数应试策略(已下线)2019年7月7日 《每日一题》 2020年高考一轮复习-每周一测(已下线)专题1.1 物质的量 气体摩尔体积(练)-《2020年高考一轮复习讲练测》(已下线)专题三 化学常用计量与阿伏加德罗常数(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)专题讲座(一) 阿伏加德罗常数的突破(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)河北省安平中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)安徽省皖中地区2019届高三入学摸底考试化学试题辽宁省葫芦岛市第六中学2019届高三上学期开学考试(8月)化学试题甘肃省甘谷县第一中学2019届高三上学期第一次检测考试化学试题山东省临沂市第十九中学2019届高三上学期第三次质量调研考试化学试题四川省攀枝花市第十二中学2019届高三上学期10月月考化学试题河北省邯郸市大名县第一中学2018-2019学年高二(清北班)5月月考化学试题辽宁省阜新市第二高级中学2018-2019学年高二下学期期末考试化学试题百所名校联考-从实验学化学黑龙江省牡丹江市第三高级中学2018-2019学年高二下学期期末考试化学试题黑龙江省宾县一中2020届高三上学期第一次月考化学试题新疆霍城县江苏中学2019届高三第二次模拟考试化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题河北省石家庄市第二中学2020届高三下学期教学质量检测模拟考试理综化学试题河北省承德市第一中学2019-2020学年高二下学期3月疫情期间直播课堂检测化学试题(已下线)广东省深圳中学2020届高三2月份网络教学质量监测理综化学试题2020届湖南省长沙市礼雅中学高中毕业班四月份网络教学质量监测卷理科综合化学部分西藏自治区拉萨市拉萨中学2020届高三第七次月考试理综化学试题广西北流市实验中学2019-2020学年高二下学期期中考试理科综合化学试题山西省运城市稷山中学2022届高三上学期月考(一)化学试题云南省罗平县第五中学2021-2022学年高二下学期6月月考化学试题四川省成都市树德中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
6 . 下列说法错误的是
| A.将14%的KOH溶液蒸发掉100g水后,变为28%的KOH溶液80mL,该80mL溶液的物质的量浓度为6.25mol/L |
B.将质量分数为98%的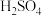 与水等体积混合,混合后 与水等体积混合,混合后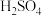 的质量分数大于49% 的质量分数大于49% |
C.某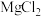 溶液的密度为1.2 溶液的密度为1.2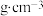 , ,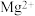 的质量分数为5%,1L该溶液中 的质量分数为5%,1L该溶液中 的物质的量为5mol 的物质的量为5mol |
D.1mol氧气在放电条件下,有30%转化为 ,则放电后混合气体对氢气的相对密度是35.6 ,则放电后混合气体对氢气的相对密度是35.6 |
您最近一年使用:0次
2022-10-12更新
|
1066次组卷
|
3卷引用:专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)
(已下线)专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)辽宁省实验中学2023届高三上学期第一次阶段测试化学试题辽宁省沈阳市皇姑屯区实验中学2022-2023学年高三上学期第一阶段检测化学试题
7 . 设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol环氧乙烷( )中含有共价键的总数为0.3NA )中含有共价键的总数为0.3NA |
| B.1molD2O比1molH2O多NA个质子 |
| C.2.8gN2与CO混合气体中含有分子数为0.1NA |
| D.16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA |
您最近一年使用:0次
2022-04-24更新
|
1111次组卷
|
3卷引用:微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题
(已下线)微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题广东省茂名市2022届高三第二次综合测试(二模)化学试题天津市河北区2022-2023学年高三下学期总复习质量监测(二)化学试题
名校
8 . 我国科学家发现了用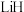 介导苯胺氢解生成苯和氨气的化学链循环方法,其过程如图所示。设阿伏加德罗常数的值为
介导苯胺氢解生成苯和氨气的化学链循环方法,其过程如图所示。设阿伏加德罗常数的值为 ,下列说法正确的是
,下列说法正确的是
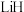 介导苯胺氢解生成苯和氨气的化学链循环方法,其过程如图所示。设阿伏加德罗常数的值为
介导苯胺氢解生成苯和氨气的化学链循环方法,其过程如图所示。设阿伏加德罗常数的值为 ,下列说法正确的是
,下列说法正确的是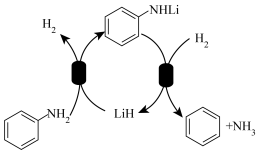
A. 苯胺中 苯胺中 键数目为 键数目为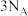 | B.反应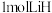 电子转移数目为 电子转移数目为 |
C. 中约含电子数目为 中约含电子数目为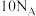 | D.生成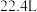 苯需消耗 苯需消耗 分子数目为 分子数目为 |
您最近一年使用:0次
2023-02-14更新
|
978次组卷
|
5卷引用:专题03 阿伏伽德罗常数的应用
(已下线)专题03 阿伏伽德罗常数的应用广东省茂名市2023届高三下学期一模考试化学试题(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)山东省青岛市第二中学2022-2023学年高二5月月考化学试题湖南省岳阳市2024届高三下学期考情信息卷化学试题
9 . 实验室中利用氧化铜和氧化铁混合物进行如图实验。下列说法错误的是

| A.“3.04g固体”一定是铁铜混合物 |
| B.“溶液2”中溶质的物质的量为0.1mol |
| C.混合物中含氧元素的物质的量为0.06mol |
| D.反应②能生成0.04gH2 |
您最近一年使用:0次
2022-04-14更新
|
2022次组卷
|
7卷引用:专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)
(已下线)专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第07练 铁及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)题型8 利用守恒关系的计算-高考必备50个题型山东省青岛市2021-2022学年高三下学期第一次模拟考试化学试题山东省青岛第三十九中学2022-2023学年高三上学期期中考试化学试题湖北省武汉市第三中学2022-2023学年高一上学期12月月考化学试题浙江省杭州市西湖高级中学2023-2024学年高一下学期4月期中考试化学试题
10 . 用 消除
消除 的反应为
的反应为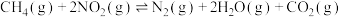
 。下列说法正确的是
。下列说法正确的是
 消除
消除 的反应为
的反应为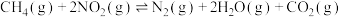
 。下列说法正确的是
。下列说法正确的是A.平衡时升高温度, 增大, 增大, 减小 减小 |
B.反应平衡常数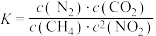 |
C.反应中生成22.4 L  ,转移电子数目为 ,转移电子数目为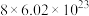 |
D.实际应用中,适当增加 的量有利于消除 的量有利于消除 ,减轻空气污染程度 ,减轻空气污染程度 |
您最近一年使用:0次
2023-03-31更新
|
987次组卷
|
3卷引用:考点巩固卷08 化学反应速率与化学平衡(3大考点45题)-2024年高考化学一轮复习考点通关卷(新高考通用)



