21-22高一下·全国·单元测试
解题方法
1 . 新型无机非金属材料
(1)硅单质
①Si位于元素周期表第_______ 周期,第_______ 族,处于金属与非金属过渡位置,为半导体材料。硅在地壳中含量仅次于氧,居第2位。
②硅在自然界的存在形态:没有游离态,只有化合态_______ 、硅酸盐。
③用途:主要用来做集成电路、晶体管、硅整流器等_______ 材料,还可以制成太阳能电池、硅的合金可用来制造变压器铁芯等。
(2)二氧化硅(硅石)
①SiO2是自然界中沙子、石英的主要成分。天然二氧化硅叫_______ ;结晶的二氧化硅叫_______ 。二氧化硅可以用来制造_______ ,具有优良的性能。
②光导纤维主要特性:①抗干扰性能好,不发生辐射;②通讯质量好;③质量轻、耐腐蚀。
(1)硅单质
①Si位于元素周期表第
②硅在自然界的存在形态:没有游离态,只有化合态
③用途:主要用来做集成电路、晶体管、硅整流器等
(2)二氧化硅(硅石)
①SiO2是自然界中沙子、石英的主要成分。天然二氧化硅叫
②光导纤维主要特性:①抗干扰性能好,不发生辐射;②通讯质量好;③质量轻、耐腐蚀。
您最近一年使用:0次
2 . (一)材料是人类赖以生存和发展的物质基础,人类使用的材料除了金属材料,还有无机非金属材料等。下列物品或设施:
①陶瓷餐具 ②砖瓦 ③混凝土桥墩 ④门窗玻璃 ⑤水晶镜片 ⑥石英钟 ⑦玛瑙
⑧硅太阳能电池 ⑨光导纤维 ⑩计算机芯片
(1)使用了硅单质的是:__________ (填序号,下同)。
(2)使用了二氧化硅的是:__________ 。
(3)使用了硅酸盐材料的是:__________ 。
(二)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: SiHCl3+H2,生成物SiHCl3的结构式为:
SiHCl3+H2,生成物SiHCl3的结构式为:_________ 。
(5)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为:__________ 。若反应完得到粗硅的质量m1kg,粗硅的纯度为98%,所用原料石英砂为m2kg,求石英砂中二氧化硅的含量为_______ %(用含m1、m2的式子表示计算过程,可不用化简)
(三)Na2SiO3溶液俗称水玻璃
(6)往Na2SiO3溶液中通入足量CO2气体能看到的现象是________ 。用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作__________ 。实验室盛放碱溶液的试剂瓶用橡胶塞不用玻璃塞,请用化学方程式解释原因:__________________ 。
①陶瓷餐具 ②砖瓦 ③混凝土桥墩 ④门窗玻璃 ⑤水晶镜片 ⑥石英钟 ⑦玛瑙
⑧硅太阳能电池 ⑨光导纤维 ⑩计算机芯片
(1)使用了硅单质的是:
(2)使用了二氧化硅的是:
(3)使用了硅酸盐材料的是:
(二)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
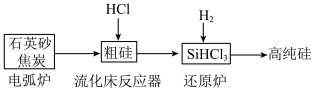
 SiHCl3+H2,生成物SiHCl3的结构式为:
SiHCl3+H2,生成物SiHCl3的结构式为:(5)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为:
(三)Na2SiO3溶液俗称水玻璃
(6)往Na2SiO3溶液中通入足量CO2气体能看到的现象是
您最近一年使用:0次
3 . 硅是带来人类文明的重要元素之一,工业上可用石英砂制备硅单质。
(1)硅和锗(Ge)属于同主族元素。下列推测不合理的是___________ (填字母)。
a.Ge与Si的最外层电子数均为4 b.常温下 是气体
是气体
c.酸性: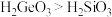 d.Si和Ge都可做半导体材料
d.Si和Ge都可做半导体材料
(2)下图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。

①洗涤石英砂的目的是___________ 。
②在以上流程中,能否将盐酸改为NaOH溶液,请说明理由:___________ 。
(3)氮化硅( )是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气中制得。反应的化学方程式为
)是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气中制得。反应的化学方程式为 。
。
①该反应中的氧化剂为___________ (填化学式)。
②若生成标准状况下16.8L CO,则生成氮化硅的质量是___________ (保留1位小数)。
(4)我国成功发射了嫦娥一号探测卫星,对月球土壤中14种元素的分布及含量进行探测。月球上的主要矿物有辉石(主要成分为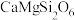 )、斜长石(主要成分为
)、斜长石(主要成分为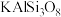 )和橄榄石(主要成分为
)和橄榄石(主要成分为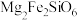 )等,橄榄石的主要成分中铁元素为
)等,橄榄石的主要成分中铁元素为___________ 价,橄榄石的主要成分的氧化物形式可表示为___________ 。辉石、斜长石及橄榄石的主要成分均属于___________ (填“氧化物”“混合物”或“硅酸盐”)。
(1)硅和锗(Ge)属于同主族元素。下列推测不合理的是
a.Ge与Si的最外层电子数均为4 b.常温下
 是气体
是气体c.酸性:
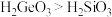 d.Si和Ge都可做半导体材料
d.Si和Ge都可做半导体材料(2)下图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。

①洗涤石英砂的目的是
②在以上流程中,能否将盐酸改为NaOH溶液,请说明理由:
(3)氮化硅(
 )是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气中制得。反应的化学方程式为
)是一种重要的结构陶瓷材料,可由石英与焦炭在高温的氮气中制得。反应的化学方程式为 。
。①该反应中的氧化剂为
②若生成标准状况下16.8L CO,则生成氮化硅的质量是
(4)我国成功发射了嫦娥一号探测卫星,对月球土壤中14种元素的分布及含量进行探测。月球上的主要矿物有辉石(主要成分为
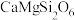 )、斜长石(主要成分为
)、斜长石(主要成分为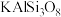 )和橄榄石(主要成分为
)和橄榄石(主要成分为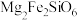 )等,橄榄石的主要成分中铁元素为
)等,橄榄石的主要成分中铁元素为
您最近一年使用:0次
名校
解题方法
4 . 化学关系着我们的衣、食、住、行。
(1)现在的多数衣服的材料为(或含有)合成纤维,合成纤维主要是由来自石油的化工气体乙烯 与丙烯
与丙烯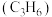 为基础原料合成的。
为基础原料合成的。
①同温同压下,乙烯气体与丙烯气体的密度之比为___________ 。
②相等物质的量的乙烯与丙烯完全燃烧,生成 的质量比为
的质量比为___________ 。
③相等质量的乙烯与丙烯完全燃烧,生成的 在相同条件下的体积比为
在相同条件下的体积比为___________ 。
(2)碘酸钾是目前我国最常用的食盐补碘剂。
①已知反应: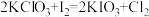 ,则下列说法正确的是
,则下列说法正确的是___________ (填字母序号)。
A.该反应属于置换反应 B.该反应中 被还原为
被还原为
C.该反应中还原剂为 D.该反应中氧化剂为
D.该反应中氧化剂为
②已知反应: ,请用双线桥法标出该反应中电子转移的方向和数目
,请用双线桥法标出该反应中电子转移的方向和数目___________ 。
(3) 及硅酸盐在房屋建筑等基础设施上得到了广泛的应用。
及硅酸盐在房屋建筑等基础设施上得到了广泛的应用。
①下列物品或设施所用材料为 或成分含有
或成分含有 的是
的是___________ (填字母序号)。
A.门窗玻璃 B.太阳能电池 C.光导纤维 D.计算机芯片
② 是一种常用的硅酸盐,其水溶液俗称水玻璃,是制备硅胶与木材防火剂的原料。水玻璃贮存时需注意密封,否则易吸收空气中的某种气体而变质,写出水玻璃因在空气中敞口放置而变质的离子方程式
是一种常用的硅酸盐,其水溶液俗称水玻璃,是制备硅胶与木材防火剂的原料。水玻璃贮存时需注意密封,否则易吸收空气中的某种气体而变质,写出水玻璃因在空气中敞口放置而变质的离子方程式___________ 。
(4)飞机、汽车、自行车上使用了大量的合金材料。
①我国使用最早的合金是___________ 。
②镁铝合金被广泛用于山地自行车,小明欲测定某镁铝合金(假设只有镁铝两种金属熔合而成)中的铝含量。小明首先称取 合金,用过量的盐酸将合金完全溶解,然后向所得溶液中加入过量的
合金,用过量的盐酸将合金完全溶解,然后向所得溶液中加入过量的 溶液,过滤,将滤渣洗涤、干燥、灼烧后得到的固体的质量仍是
溶液,过滤,将滤渣洗涤、干燥、灼烧后得到的固体的质量仍是 。则该镁铝合金中的铝的质量百分含量为
。则该镁铝合金中的铝的质量百分含量为___________ 。
(1)现在的多数衣服的材料为(或含有)合成纤维,合成纤维主要是由来自石油的化工气体乙烯
 与丙烯
与丙烯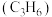 为基础原料合成的。
为基础原料合成的。①同温同压下,乙烯气体与丙烯气体的密度之比为
②相等物质的量的乙烯与丙烯完全燃烧,生成
 的质量比为
的质量比为③相等质量的乙烯与丙烯完全燃烧,生成的
 在相同条件下的体积比为
在相同条件下的体积比为(2)碘酸钾是目前我国最常用的食盐补碘剂。
①已知反应:
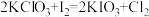 ,则下列说法正确的是
,则下列说法正确的是A.该反应属于置换反应 B.该反应中
 被还原为
被还原为
C.该反应中还原剂为
 D.该反应中氧化剂为
D.该反应中氧化剂为
②已知反应:
 ,请用双线桥法标出该反应中电子转移的方向和数目
,请用双线桥法标出该反应中电子转移的方向和数目(3)
 及硅酸盐在房屋建筑等基础设施上得到了广泛的应用。
及硅酸盐在房屋建筑等基础设施上得到了广泛的应用。①下列物品或设施所用材料为
 或成分含有
或成分含有 的是
的是A.门窗玻璃 B.太阳能电池 C.光导纤维 D.计算机芯片
②
 是一种常用的硅酸盐,其水溶液俗称水玻璃,是制备硅胶与木材防火剂的原料。水玻璃贮存时需注意密封,否则易吸收空气中的某种气体而变质,写出水玻璃因在空气中敞口放置而变质的离子方程式
是一种常用的硅酸盐,其水溶液俗称水玻璃,是制备硅胶与木材防火剂的原料。水玻璃贮存时需注意密封,否则易吸收空气中的某种气体而变质,写出水玻璃因在空气中敞口放置而变质的离子方程式(4)飞机、汽车、自行车上使用了大量的合金材料。
①我国使用最早的合金是
②镁铝合金被广泛用于山地自行车,小明欲测定某镁铝合金(假设只有镁铝两种金属熔合而成)中的铝含量。小明首先称取
 合金,用过量的盐酸将合金完全溶解,然后向所得溶液中加入过量的
合金,用过量的盐酸将合金完全溶解,然后向所得溶液中加入过量的 溶液,过滤,将滤渣洗涤、干燥、灼烧后得到的固体的质量仍是
溶液,过滤,将滤渣洗涤、干燥、灼烧后得到的固体的质量仍是 。则该镁铝合金中的铝的质量百分含量为
。则该镁铝合金中的铝的质量百分含量为
您最近一年使用:0次
19-20高一·全国·期末
解题方法
5 . 化学材料与人们生活质量的提高以及社会发展有着密切的关系。南昌市地铁三号线正在紧张建设中,在建设施工中要大量使用各种材料,比如水泥、玻璃、钢铁等。
(1)生产硅酸盐水泥和普通玻璃都需要用到的主要原料是_________ (填名称);某玻璃厂生产普通玻璃,其组成为(质量分数):Na2O−13%,CaO−11.7%,SiO2−75.3%。
写出以氧化物组成的形式表示该玻璃的化学式________________ (结果取最简整数比)。
(2)在地铁信息传输系统中,大量用到了电缆、光纤和无线传输等材料和方式,其中光纤的主要成分是________________ (填化学式)。
(3)地铁轨道要求具有高强度的抗磨性能,还要有很好的机械强度。你认为以下材料适合做地铁轨道的是_______________ (填字母序号)。
a.硬铝b.钛合金c.锰钢d.硅钢
(4)地铁车辆主要有不锈钢车体和铝合金车体两种,下列有关不锈钢和铝合金的叙述正确的是_____________ (填字母序号)。
a.都属于合金材料
b.在空气中均具有较好的耐腐蚀性
c.不锈钢是在含碳量低于0.3%的低碳钢表面镀上一层耐腐蚀的金属材料
d.在轻量化上铝合金车体效果要比不锈钢车体更好
(1)生产硅酸盐水泥和普通玻璃都需要用到的主要原料是
写出以氧化物组成的形式表示该玻璃的化学式
(2)在地铁信息传输系统中,大量用到了电缆、光纤和无线传输等材料和方式,其中光纤的主要成分是
(3)地铁轨道要求具有高强度的抗磨性能,还要有很好的机械强度。你认为以下材料适合做地铁轨道的是
a.硬铝b.钛合金c.锰钢d.硅钢
(4)地铁车辆主要有不锈钢车体和铝合金车体两种,下列有关不锈钢和铝合金的叙述正确的是
a.都属于合金材料
b.在空气中均具有较好的耐腐蚀性
c.不锈钢是在含碳量低于0.3%的低碳钢表面镀上一层耐腐蚀的金属材料
d.在轻量化上铝合金车体效果要比不锈钢车体更好
您最近一年使用:0次
6 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐占地壳质量的90%以上。
(1)写出地壳中含量最高的元素的符号:_______ 。
(2)写出通信中硅的氧化物的一种用途:_______ 。
(3)科学家用金属钠、四氯化碳和四氯化硅制得了碳化硅纳米棒,反应的化学方程式为 。
。
①该反应中Si元素的化合价为_______ 价。
②其中还原产物的化学式为_______ 。
③高温真空环境中,C与SiO2反应也可以生成SiC,写出该反应的化学方程式:_______ 。
(4)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3溶液可以用作_______ ;设计简单实验比较醋酸与H2SiO3酸性的强弱:_______ 。
(1)写出地壳中含量最高的元素的符号:
(2)写出通信中硅的氧化物的一种用途:
(3)科学家用金属钠、四氯化碳和四氯化硅制得了碳化硅纳米棒,反应的化学方程式为
 。
。①该反应中Si元素的化合价为
②其中还原产物的化学式为
③高温真空环境中,C与SiO2反应也可以生成SiC,写出该反应的化学方程式:
(4)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3溶液可以用作
您最近一年使用:0次
解题方法
7 . 地壳中含量最高的金属元素是___ ,Na2CO3俗称___ ,制造计算机芯片的半导体材料是___ ,光导纤维的主要成分是____ 。
您最近一年使用:0次
8 . 化学与人们生活质量的提高以及社会发展有着密切的关系.
(1)①工业上制造水泥、玻璃和高炉炼铁都要用到的原料是_____ (填字母).
a.纯碱 b.石灰石 c.黏土
②光导纤维的主要成分是__________ (填化学式).
(2)泡沫铝是一种新型材料,它是在熔融的铝合金中加入发泡剂制成的,其优点是硬度高,密度小,比木材还轻,可浮于水面,又有很大的刚性,且隔音、保温,是一种良好的建筑材料和轻质材料.
①下列关于泡沫铝的说法错误的是__________ (填字母).
a.是纯净物 b.可用来制造飞机 c.可用作隔热材料
②铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝及其化合物在下列场合使用时必须加以控制的是__________ (填字母).
a.制电线电缆 b.用明矾净水 c.制防锈油漆
(3)如图为实验室中盐酸试剂瓶标签上的部分内容.试回答下列问题:
①下列有关浓盐酸的说法中正确的是__________ (填字母).
a.属于含氧酸 b.和氯化氢的性质相同 c.很容易挥发
②该盐酸的c(HCl)为__________ mol/L.
③欲用该盐酸配制1.19mol/L的盐酸480mL.请完成下列有关操作中的空白:
a.用量筒准确量取该盐酸__________ mL,注入烧杯中,加入适量的水,混合均匀;
b.将操作a所得的盐酸沿玻璃棒注入__________ mL容量瓶中;
c.用适量的水洗涤烧杯、玻璃棒2~3次,洗涤液均注入容量瓶中,振荡;
d.缓缓地将蒸馏水注入容量瓶中,直到瓶中的液面接近容量瓶的刻度线l~2cm处,改用__________ 加蒸馏水至溶液的凹液面正好与刻度线相切;
e.将容量瓶盖好,反复上下颠倒摇匀.
(4)通常用饱和NaHCO3溶液除去混在CO2中的少量HCl气体,其反应离子方程式为_____________ ;不能用NaOH溶液的原因是__________________ (以下均用离子方程表示);也不能用Na2CO3溶液吸收的原因是______________ 。
(5)王水的成分和比例是:______________ 。
(1)①工业上制造水泥、玻璃和高炉炼铁都要用到的原料是
a.纯碱 b.石灰石 c.黏土
②光导纤维的主要成分是
(2)泡沫铝是一种新型材料,它是在熔融的铝合金中加入发泡剂制成的,其优点是硬度高,密度小,比木材还轻,可浮于水面,又有很大的刚性,且隔音、保温,是一种良好的建筑材料和轻质材料.
①下列关于泡沫铝的说法错误的是
a.是纯净物 b.可用来制造飞机 c.可用作隔热材料
②铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝及其化合物在下列场合使用时必须加以控制的是
a.制电线电缆 b.用明矾净水 c.制防锈油漆
(3)如图为实验室中盐酸试剂瓶标签上的部分内容.试回答下列问题:
| 盐酸 分子式:HCI 相对分子质量:36.5 密度:1.19g/mL HCl的质量分数:36.5% |
①下列有关浓盐酸的说法中正确的是
a.属于含氧酸 b.和氯化氢的性质相同 c.很容易挥发
②该盐酸的c(HCl)为
③欲用该盐酸配制1.19mol/L的盐酸480mL.请完成下列有关操作中的空白:
a.用量筒准确量取该盐酸
b.将操作a所得的盐酸沿玻璃棒注入
c.用适量的水洗涤烧杯、玻璃棒2~3次,洗涤液均注入容量瓶中,振荡;
d.缓缓地将蒸馏水注入容量瓶中,直到瓶中的液面接近容量瓶的刻度线l~2cm处,改用
e.将容量瓶盖好,反复上下颠倒摇匀.
(4)通常用饱和NaHCO3溶液除去混在CO2中的少量HCl气体,其反应离子方程式为
(5)王水的成分和比例是:
您最近一年使用:0次



