1 . 铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,生成的气体为NO、 。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗
。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗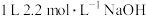 溶液和
溶液和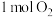 ,则生成的NO、
,则生成的NO、 的物质的量分别为
的物质的量分别为_______ 、_______ ,生成硫酸铜的物质的量为_________________ 。
 。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗
。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗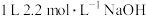 溶液和
溶液和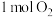 ,则生成的NO、
,则生成的NO、 的物质的量分别为
的物质的量分别为
您最近一年使用:0次
2020-09-23更新
|
452次组卷
|
2卷引用:高一必修第一册(鲁科2019)第3章 第3节 氮的循环 高考帮
2 . 为了测定某铜银合金成分,将30.0g合金溶于80mL13.5mol•L-1的浓硝酸中,待反应完全后,收集到6.72L气体(已换算成标准状况),并测得溶液中c(H+)=1mol•L-1。假设反应后溶液的体积仍为80mL,试计算(已知Ag可与HNO3反应):
(1)被还原的HNO3的物质的量为___ ;
(2)合金中银的质量分数为__ 。
(1)被还原的HNO3的物质的量为
(2)合金中银的质量分数为
您最近一年使用:0次
2020-09-23更新
|
1451次组卷
|
4卷引用:鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 课时3 硝酸
解题方法
3 . 在浓硝酸中放入铜片:
(1)反应开始时的化学方程式为______ ,实验现象为_________ 。
(2)若铜片有剩余,则反应将要结束时的化学方程式为__________ 。
(3)待反应停止后,再加入少量的稀硫酸,这时,铜片上又有气泡产生,原因是_______ 。
(4)若将 铜与一定量的浓硝酸反应,铜消耗完后,共产生气体
铜与一定量的浓硝酸反应,铜消耗完后,共产生气体 (标准状况),则所消耗的硝酸的物质的量是
(标准状况),则所消耗的硝酸的物质的量是______ (气体中不含 )。
)。
(1)反应开始时的化学方程式为
(2)若铜片有剩余,则反应将要结束时的化学方程式为
(3)待反应停止后,再加入少量的稀硫酸,这时,铜片上又有气泡产生,原因是
(4)若将
 铜与一定量的浓硝酸反应,铜消耗完后,共产生气体
铜与一定量的浓硝酸反应,铜消耗完后,共产生气体 (标准状况),则所消耗的硝酸的物质的量是
(标准状况),则所消耗的硝酸的物质的量是 )。
)。
您最近一年使用:0次
2020-09-11更新
|
442次组卷
|
4卷引用:鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 课时3 硝酸
鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 课时3 硝酸高一必修第二册(人教2019版)第五章 第二节 氮及其化合物 课时3 硝酸(已下线)5.2.3 硝酸(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)2015-2016学年山东省淄博市高青一中高一4月月考化学试卷
4 . 铜是重要的工业原料,现有 、
、 组成的混合物,某研究性学习小组为了探究其组成情况,取
组成的混合物,某研究性学习小组为了探究其组成情况,取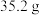 该混合物加入
该混合物加入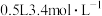 的稀硝酸中,固体物质完全反应,生成
的稀硝酸中,固体物质完全反应,生成 (标准状况)的
(标准状况)的 。向所得溶液中加入
。向所得溶液中加入 的
的 溶液,恰好使溶液中的
溶液,恰好使溶液中的 沉淀完全。
沉淀完全。
(1) 与稀硝酸反应的化学方程式为
与稀硝酸反应的化学方程式为____________ 。
(2)混合物中,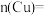
______ ;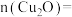
________ 。
(3)
______
 、
、 组成的混合物,某研究性学习小组为了探究其组成情况,取
组成的混合物,某研究性学习小组为了探究其组成情况,取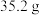 该混合物加入
该混合物加入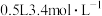 的稀硝酸中,固体物质完全反应,生成
的稀硝酸中,固体物质完全反应,生成 (标准状况)的
(标准状况)的 。向所得溶液中加入
。向所得溶液中加入 的
的 溶液,恰好使溶液中的
溶液,恰好使溶液中的 沉淀完全。
沉淀完全。(1)
 与稀硝酸反应的化学方程式为
与稀硝酸反应的化学方程式为(2)混合物中,
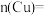
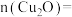
(3)

您最近一年使用:0次
2020-03-05更新
|
1313次组卷
|
13卷引用:人教版(2019)必修第二册第五章第三节 课时3 硝酸 酸雨及其防治
人教版(2019)必修第二册第五章第三节 课时3 硝酸 酸雨及其防治必修第二册RJ第5章第二节 氮及其化合物 课时3 硝酸 酸雨及其防治(苏教版2019)必修第二册专题7 氮与社会可持续发展 第二单元 重要的含氮化工原料 课时2 硝酸河北省鸡泽县第一中学2018届高三上学期第一次月考化学试题(已下线)【艺体生百日捷进提升系列-技能方法】专题3.10 氮族方面试题的解题方法与技巧鲁教版高中必修1化学第三章《自然界中的元素》测试卷鲁科版高中化学必修1第三章《自然界中的元素》测试卷人教版高中化学必修1第四章《非金属及其化合物》测试卷4人教版高一化学必修1第四章《非金属及其化合物》测试卷2020年春季鲁教版高中化学必修1第3章《自然界中的元素》测试卷2020年春季苏教版高中化学苏教版必修1专题四《硫、氮和可持续发展》测试卷内蒙古巴彦淖尔市乌拉特前旗第一中学2019-2020学年高一下学期第一次月考化学试题(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测
12-13高一上·贵州黔南·期末
名校
5 . 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为________ L,NO2的体积为________ L。
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部转化成沉淀,则原硝酸溶液的浓度为__________ mol/L。
(1)NO的体积为
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部转化成沉淀,则原硝酸溶液的浓度为
您最近一年使用:0次
2017-11-27更新
|
1130次组卷
|
9卷引用:4.4.2 硫酸和硝酸的氧化性
(已下线)4.4.2 硫酸和硝酸的氧化性高中化学人教版 必修1 第四章 非金属及其化合物 4.氨 硫酸 硝酸 硫酸安徽省淮北市第一中学2019-2020学年高一下学期《氮及其化合物性质》 跟进作业 (第三课时)(已下线)2011-2012学年贵州省瓮安二中高一上学期期末考试化学试卷(已下线)2012-2013学年福建省南安一中高一下学期期中考试化学试卷2014-2015学年甘肃省武威市六中高一下模块终结性检测化学理试卷湖南省衡东县第一中学2017-2018第一学期高一化学期末考试2018年高一化学(人教版)必修1综合题型练习卷:非金属及其化合物河南省许昌市长葛市第一高级中学2020-2021学年高一上学期9月月考化学试题
名校
6 . 50 mL浓H2SO4溶液(足量)中加入3.2 g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________ ,生成SO2的体积为(标准状况下)____________ mL。
(2)若题干中浓硫酸的物质的量浓度为a mol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)_______ 0.025a mol(填“等于”、“大于”或“小于”)。
(3)将题干中反应后的溶液稀释到500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81 g,则原浓硫酸的物质的量浓度为_____________ 。
(1)反应消耗的H2SO4的物质的量是
(2)若题干中浓硫酸的物质的量浓度为a mol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)
(3)将题干中反应后的溶液稀释到500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81 g,则原浓硫酸的物质的量浓度为
您最近一年使用:0次
2017-04-28更新
|
1998次组卷
|
14卷引用:2018-2019学年高中化学鲁科版必修1 章末综合测评3
2018-2019学年高中化学鲁科版必修1 章末综合测评3人教版(2019)必修第二册第五章第一节课时2鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时3 硫酸必修第二册RJ第5章第一节 硫及其化合物 课时2 硫酸硫酸根离子的检验高一必修第一册(苏教2019版)专题4 第一单元 含硫化合物的性质 课时2 硫酸的工业制备和浓硫酸的性质湖北省武汉市第二中学、麻城市第一中学2016-2017学年高一下学期期中联考化学试题【全国百强校】青海省平安县第一高级中学2017-2018学年高一下学期期中考试(A卷)化学试题2018-2019学年人教版高中化学必修一:非金属及其化合物章末综合测评(四)(已下线)2018年12月11日 《每日一题》人教必修1-浓硫酸的特性(已下线)2018年12月16日 《每日一题》人教必修1- 每周一测(已下线)2019年1月11日 《每日一题》人教必修1-浓硫酸与硝酸的氧化性及特性(已下线)2019年12月10日 《每日一题》化学人教版(必修1)——浓硫酸的特性(已下线)2019年12月15日 《每日一题》化学人教版(必修1)——每周一测2020年春季苏教版高中化学苏教版必修1专题四《硫、氮和可持续发展》测试卷
7 . 把2.0 mol/L Fe2(SO4)3溶液和2.0 mol/L H2SO4等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和)。计算:(写出计算过程)
(1)混合液中Fe3+的物质的量浓度;
(2)混合液中H+、SO42—的物质的量浓度;
(3)向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余, 求此时溶液中FeSO4的物质的量浓度。
(已知加入铁粉时先发生Fe+ Fe2(SO4)3="3Fe" SO4 反应,后发生Fe+ H2SO4="Fe" SO4+ H2)
(4)假设混和后的溶液为2L,加入一定量Fe粉后放出H2在标准状况下的体积为16.8L,求最终溶液中H+物质的量浓度。
(1)混合液中Fe3+的物质的量浓度;
(2)混合液中H+、SO42—的物质的量浓度;
(3)向溶液中加入足量铁粉,经足够长时间后,铁粉有剩余, 求此时溶液中FeSO4的物质的量浓度。
(已知加入铁粉时先发生Fe+ Fe2(SO4)3="3Fe" SO4 反应,后发生Fe+ H2SO4="Fe" SO4+ H2)
(4)假设混和后的溶液为2L,加入一定量Fe粉后放出H2在标准状况下的体积为16.8L,求最终溶液中H+物质的量浓度。
您最近一年使用:0次
2015-09-30更新
|
590次组卷
|
2卷引用:2018-2019学年鲁科版必修1 第1章第3节 化学中常用的物理量-物质的量练习题



