解题方法
1 . 含氮化合物的研发与绿色反展、经济可持续发展有着密切关联。
(1)氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。
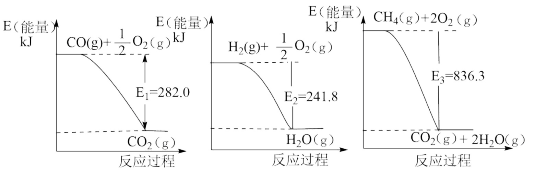
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:_______ 。
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g) N2O4(g)。
N2O4(g)。
每隔一定时间测定容器内各物质的物质的量,数据如下表:
①当反应在1500C达到平衡时,该反应平衡常数K=________ 。(填数值)
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为_______ 。
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物_______ g。
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)==CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:①b应控制在________ ;
A.1.5. 1.6 B.1~1.1 C.0.6~0.7
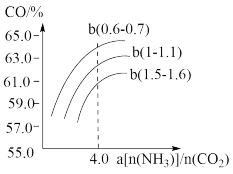
②a应控制在4.0的理由是_______ 。
(1)氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。

则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)
 N2O4(g)。
N2O4(g)。每隔一定时间测定容器内各物质的物质的量,数据如下表:
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在1500C达到平衡时,该反应平衡常数K=
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)==CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:①b应控制在
A.1.5. 1.6 B.1~1.1 C.0.6~0.7

②a应控制在4.0的理由是
您最近一年使用:0次



