1 . 二氧化碳转化为甲醇有利于实现碳中和。
(1)二氧化碳合成甲醇经历以下两步:



则合成总反应
_______  。
。
(2)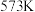 时,在体积为
时,在体积为 的刚性容器中,投入
的刚性容器中,投入 和
和 ,合成总反应达到平衡时,
,合成总反应达到平衡时, 的平衡转化率为
的平衡转化率为 。
。
①该反应的平衡常数K=_______ (保留1位小数)。
②有利于提高 平衡转化率的是
平衡转化率的是_______ (填标号)。
A.降低温度 B.继续通入 C.及时将
C.及时将 分离 D.使用合适催化剂
分离 D.使用合适催化剂
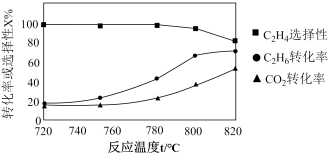
(3)我国科学家制备了一种 催化剂,实现
催化剂,实现 高选择性合成
高选择性合成 。气相催化合成过程中,
。气相催化合成过程中, 转化常
转化常 及
及 选择性
选择性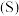 随温度及投料比的变化曲线如图。
随温度及投料比的变化曲线如图。
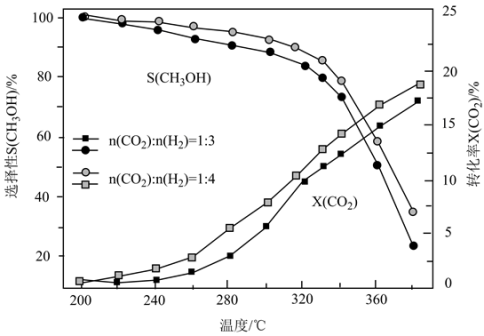
①生成 的最佳条件是
的最佳条件是_______ (填标号)。
A.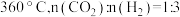 B.
B.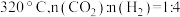
C.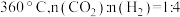 D.
D.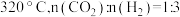
②温度升高, 转化率升高,但产物
转化率升高,但产物 含量降低的原因:
含量降低的原因:_______ 。
(4)甲醇进一步合成天然淀粉的路线如图,其中 为生物酶。
为生物酶。
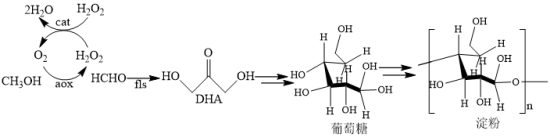
①合成天然淀粉过程中加入过氧化氢酶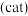 的作用是
的作用是_______ 。
②以 为原料人工合成淀粉,
为原料人工合成淀粉,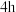 为1个周期,每克催化剂能生产
为1个周期,每克催化剂能生产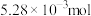 淀粉;自然界中玉米合成淀粉的效率为
淀粉;自然界中玉米合成淀粉的效率为 。该方法生产淀粉的效率是玉米的
。该方法生产淀粉的效率是玉米的_______ 倍(保留1位小数)。
(1)二氧化碳合成甲醇经历以下两步:



则合成总反应

 。
。(2)
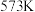 时,在体积为
时,在体积为 的刚性容器中,投入
的刚性容器中,投入 和
和 ,合成总反应达到平衡时,
,合成总反应达到平衡时, 的平衡转化率为
的平衡转化率为 。
。①该反应的平衡常数K=
②有利于提高
 平衡转化率的是
平衡转化率的是A.降低温度 B.继续通入
 C.及时将
C.及时将 分离 D.使用合适催化剂
分离 D.使用合适催化剂(3)我国科学家制备了一种
 催化剂,实现
催化剂,实现 高选择性合成
高选择性合成 。气相催化合成过程中,
。气相催化合成过程中, 转化常
转化常 及
及 选择性
选择性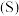 随温度及投料比的变化曲线如图。
随温度及投料比的变化曲线如图。
①生成
 的最佳条件是
的最佳条件是A.
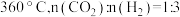 B.
B.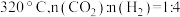
C.
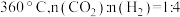 D.
D.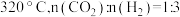
②温度升高,
 转化率升高,但产物
转化率升高,但产物 含量降低的原因:
含量降低的原因:(4)甲醇进一步合成天然淀粉的路线如图,其中
 为生物酶。
为生物酶。
①合成天然淀粉过程中加入过氧化氢酶
 的作用是
的作用是②以
 为原料人工合成淀粉,
为原料人工合成淀粉,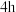 为1个周期,每克催化剂能生产
为1个周期,每克催化剂能生产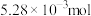 淀粉;自然界中玉米合成淀粉的效率为
淀粉;自然界中玉米合成淀粉的效率为 。该方法生产淀粉的效率是玉米的
。该方法生产淀粉的效率是玉米的
您最近半年使用:0次
2022-01-21更新
|
553次组卷
|
3卷引用:福建省四地市2022届高三上学期第一次质量检测化学试题
名校
解题方法
2 . 近年碳中和理念成为热门,通过“ →合成气→高附加值产品”的工艺路线,可有效实现
→合成气→高附加值产品”的工艺路线,可有效实现 的资源化利用。请回答下列问题:
的资源化利用。请回答下列问题:
(1) 加氢制合成气(CO、
加氢制合成气(CO、 )时发生下列反应:
)时发生下列反应:
已知:①

②
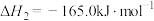
则

_______ 
(2) 经催化加氢可合成烯烃:
经催化加氢可合成烯烃:
 。在0.1MPa时,按
。在0.1MPa时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是_______ (填字母)。
A.容器内各物质的浓度不随时间变化 B.
C.容器内压强不随时间变化 D.混合气体的密度不再改变
②该反应的
_______ 0(填“>”或“<”)。
③曲线c表示的物质为_______ (用化学式表示)。
④要提高 的转化率并同时提高反应速率,可以采取什么措施
的转化率并同时提高反应速率,可以采取什么措施_______ (写出2种)。
(3)由 与
与 反应合成甲醇:
反应合成甲醇:
 。某温度下将1mol
。某温度下将1mol 和3mol
和3mol 充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
该条件下的分压平衡常数
_______  平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)电催化 制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为_______ 。当阴极只生成HCOOH时,每转移2mol电子,阴极室溶液质量增加_______ g。

 →合成气→高附加值产品”的工艺路线,可有效实现
→合成气→高附加值产品”的工艺路线,可有效实现 的资源化利用。请回答下列问题:
的资源化利用。请回答下列问题:(1)
 加氢制合成气(CO、
加氢制合成气(CO、 )时发生下列反应:
)时发生下列反应:已知:①


②

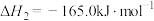
则



(2)
 经催化加氢可合成烯烃:
经催化加氢可合成烯烃:
 。在0.1MPa时,按
。在0.1MPa时,按 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化 B.

C.容器内压强不随时间变化 D.混合气体的密度不再改变
②该反应的

③曲线c表示的物质为
④要提高
 的转化率并同时提高反应速率,可以采取什么措施
的转化率并同时提高反应速率,可以采取什么措施(3)由
 与
与 反应合成甲醇:
反应合成甲醇:
 。某温度下将1mol
。某温度下将1mol 和3mol
和3mol 充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
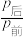 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |

 平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)电催化
 制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
制备燃料可实现资源综合利用。如图所示装置工作时,阳极的电极反应式为
您最近半年使用:0次
名校
解题方法
3 . Ⅰ.我国科学家利用CO2矿化反应释放能量设计出CO2矿化电池。不仅减碳发电,还能获得高附加值产品,其工作原理如图所示(Q是有机物;反应物和产物分别经过其它通道进入或排出电池容器)。

(1)通过离子交换膜的离子是___ ,正极区的电极反应式为:Q+2CO2+2H2O+2Na++2e—=2NaHCO3+QH2,在电极区溶液中可循环利用的物质是___ ,则电池的总反应方程式为____ 。
Ⅱ.以CO2为原料加氢合成二甲醚、甲醇有利于促进实现“碳中和”。在二氧化碳加氢制取二甲醚的合成塔中发生以下3个反应:
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=—49.01kJ·mol-1
CH3OH(g)+H2O(g) △H=—49.01kJ·mol-1
ii.2CH3OH(g) CH3OCH3(g)+H2O(g) △H=—24.52kJ·mol-1
CH3OCH3(g)+H2O(g) △H=—24.52kJ·mol-1
iii.CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.17kJ·mol-1
CO(g)+H2O(g) △H=+41.17kJ·mol-1
(2)2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)的△H=
CH3OCH3(g)+3H2O(g)的△H=___ kJ·mol-1。
(3)在压强3.0MPa、 =4条件下,CO2的平衡转化率和产物的选择性与温度的关系如图所示(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)。
=4条件下,CO2的平衡转化率和产物的选择性与温度的关系如图所示(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)。
①当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是___ 。除改变温度外,能提高二甲醚选择性的措施为____ (写一种即可)。
②根据图中的数据计算300℃上述反应达到平衡时CH3OCH3的物质的量分数为____ (保留三位有效数字)。

(4)在 =3时,反应CO2(g)+3H2(g)
=3时,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)在不同条件下达到平衡,设体系中甲醇物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~P、在P=5×105Pa下的x(CH3OH)~t如图所示。当CO2的平衡转化率为
CH3OH(g)+H2O(g)在不同条件下达到平衡,设体系中甲醇物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~P、在P=5×105Pa下的x(CH3OH)~t如图所示。当CO2的平衡转化率为 时,反应条件可能为
时,反应条件可能为____ 。
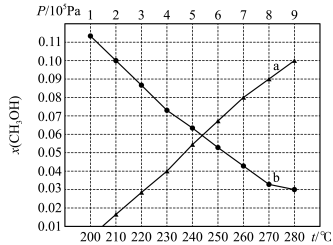

(1)通过离子交换膜的离子是
Ⅱ.以CO2为原料加氢合成二甲醚、甲醇有利于促进实现“碳中和”。在二氧化碳加氢制取二甲醚的合成塔中发生以下3个反应:
i.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=—49.01kJ·mol-1
CH3OH(g)+H2O(g) △H=—49.01kJ·mol-1ii.2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H=—24.52kJ·mol-1
CH3OCH3(g)+H2O(g) △H=—24.52kJ·mol-1iii.CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.17kJ·mol-1
CO(g)+H2O(g) △H=+41.17kJ·mol-1(2)2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)的△H=
CH3OCH3(g)+3H2O(g)的△H=(3)在压强3.0MPa、
 =4条件下,CO2的平衡转化率和产物的选择性与温度的关系如图所示(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)。
=4条件下,CO2的平衡转化率和产物的选择性与温度的关系如图所示(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)。①当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是
②根据图中的数据计算300℃上述反应达到平衡时CH3OCH3的物质的量分数为

(4)在
 =3时,反应CO2(g)+3H2(g)
=3时,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)在不同条件下达到平衡,设体系中甲醇物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~P、在P=5×105Pa下的x(CH3OH)~t如图所示。当CO2的平衡转化率为
CH3OH(g)+H2O(g)在不同条件下达到平衡,设体系中甲醇物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~P、在P=5×105Pa下的x(CH3OH)~t如图所示。当CO2的平衡转化率为 时,反应条件可能为
时,反应条件可能为
您最近半年使用:0次
2022-03-03更新
|
713次组卷
|
2卷引用:福建省龙岩第一中学2022届高三毕业班模拟训练(二)化学试题
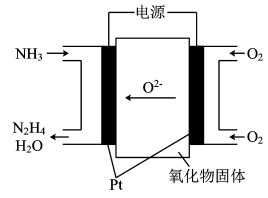
4 . (1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为___________ ,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应式_________ ;
(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)△H=-akJ/mol,已知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g)△H=-akJ/mol,已知:CO(g)+H2O(g) CO2(g)+H2(g)△H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:
CO2(g)+H2(g)△H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:_________________ 。
(3)如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

根据要求回答相关问题:
①甲装置中正极的电极反应式为:________________ 。
②乙装置中石墨电极产生产物如何检验______ ,电解一段时间后,乙池中的溶液呈___ 性。
③图中用丙装置模拟工业中的________ 原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为_____ g。

(2)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g)△H=-akJ/mol,已知:CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g)△H=-akJ/mol,已知:CO(g)+H2O(g) CO2(g)+H2(g)△H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:
CO2(g)+H2(g)△H=-bkJ/mol,以CO2(g)与H2(g)为原料也可合成气态乙醇,并放出热量,写出该反应的热化学反应方程式:(3)如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

根据要求回答相关问题:
①甲装置中正极的电极反应式为:
②乙装置中石墨电极产生产物如何检验
③图中用丙装置模拟工业中的
您最近半年使用:0次
名校
解题方法
5 .
(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式____________________________________ 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式_____________________________ 。
(3)断裂1 mol化学键所需的能量如表所示:
计算1molN2(g)与H2O(g)反应生成NH3(g)和O2(g)的反应热△H = _______________ 。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为________________ 。
(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式
(3)断裂1 mol化学键所需的能量如表所示:
| 共价键 | H—N | H—O | N≡N | O==O |
| 断裂1 mol化学键所需能量/kJ | 393 | 463 | 941 | 496 |
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近半年使用:0次
6 . 我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应I: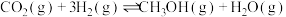
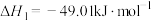
反应Ⅱ: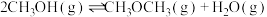
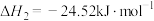
反应Ⅲ:
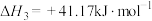
①结合计算分析反应 的自发性:
的自发性:_____ 。
②恒压、投料比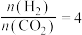 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是_____ 。
③工业实际设计温度一般在230∼270℃范围内变化,不能过高的原因是_____ 。
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。
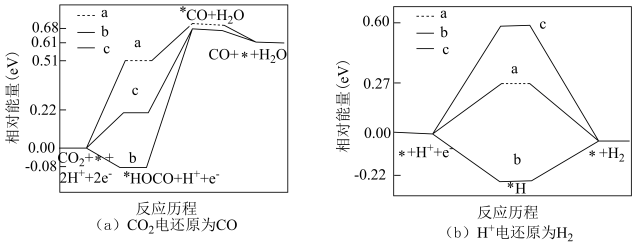
①CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_____ 。
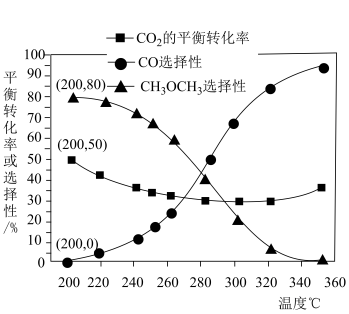
②在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为_____ (用a、b、c字母排序)。
(3)CO2参与的乙苯脱氢机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。
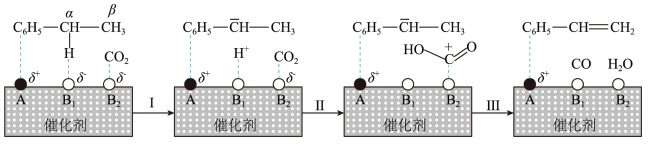
图中所示反应机理中步骤I可描述为:乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;步骤Ⅱ可描述为:_____ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应I:
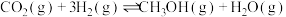
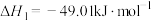
反应Ⅱ:
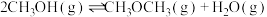
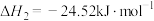
反应Ⅲ:

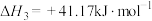
①结合计算分析反应
 的自发性:
的自发性:②恒压、投料比
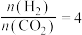 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是
③工业实际设计温度一般在230∼270℃范围内变化,不能过高的原因是
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。
①CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
②在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为

(3)CO2参与的乙苯脱氢机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。

图中所示反应机理中步骤I可描述为:乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;步骤Ⅱ可描述为:
您最近半年使用:0次
解题方法
7 . 甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
已知:①CO(g)+1/2O2(g)=CO2(g) H1
H1
②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g) CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式___________ ,该反应的反应热ΔH4=__________ (用ΔH1、ΔH2、ΔH3)。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是___________ (填选项字母,单选)。
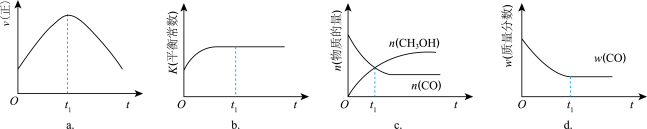
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=___________ ,T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___________ 。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:___________ 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________ 。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________ 。
 CH3OH(g)。
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g)
 H1
H1 ②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g)
 CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
您最近半年使用:0次
名校
解题方法
8 . 近年来,碳中和、碳达峰成为热点。以CO2、H2为原料生产甲醇是一种有效利用二氧化碳的途径。
途径一:涉及的反应有
I.
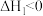
Ⅱ.

III.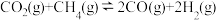
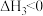
(1)关于反应I,下列描述正确的是___________(填字母序号)。
(2)根据反应I~Ⅲ,计算 ΔH=
ΔH=___________ 。
(3)工业中,对于反应I,通常同时存在副反应IV: ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。

①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________ 。
②由图b可知,ΔH4___________ 0(填“>”、“<”或“=”);H2的物质的量分数随温度升高而增大,原因是___________ 。
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为___________ 。
途径二:涉及的反应有
I.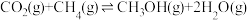
Ⅱ.
III.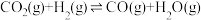
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为___________ (用含a、b、V的代数式表示)。
途径一:涉及的反应有
I.

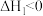
Ⅱ.


III.
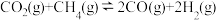
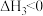
(1)关于反应I,下列描述正确的是___________(填字母序号)。
| A.恒容下达平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态 |
| C.当反应达平衡状态时,2V正(H2)=V逆(H2O) |
| D.恒温下缩小容器体积,反应物的活化分子百分数增大 |
 ΔH=
ΔH=(3)工业中,对于反应I,通常同时存在副反应IV:
 ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是
②由图b可知,ΔH4
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为
途径二:涉及的反应有
I.
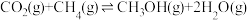
Ⅱ.

III.
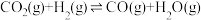
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为
您最近半年使用:0次
9 . 资源化利用 ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品.回答下列问题.
,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品.回答下列问题.
(1)理论研究表明,在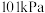 和
和 下,
下, 异构化反应过程的能量变化如图所示:计算可得
异构化反应过程的能量变化如图所示:计算可得
_____________  ,
, 与
与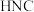 稳定性较强的是
稳定性较强的是_____________ . 吸附剂.
吸附剂.结合下图 分析聚合离子液体吸附 的有利条件是
的有利条件是_____________ .
工业上以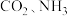 为原料生产尿素
为原料生产尿素 ,该反应分为二步进行:
,该反应分为二步进行:
第一步: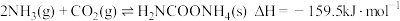
第二步: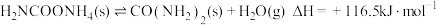
①写出上述合成尿素的热化学方程式_____________ .
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入 和
和 ,实验测得反应中各组分物质的量随时间的变化如下图所示:
,实验测得反应中各组分物质的量随时间的变化如下图所示:_____________ 步反应决定,总反应进行到_____________  时到达平衡.
时到达平衡.
(4)合成乙酸:
中国科学家首次以 和
和 为原料高效合成乙酸,其反应路径如下图所示:
为原料高效合成乙酸,其反应路径如下图所示:根据图示 ,写出总反应的化学方程式_____________ .
 ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品.回答下列问题.
,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品.回答下列问题.(1)理论研究表明,在
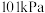 和
和 下,
下, 异构化反应过程的能量变化如图所示:计算可得
异构化反应过程的能量变化如图所示:计算可得
 ,
, 与
与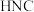 稳定性较强的是
稳定性较强的是
 吸附剂.
吸附剂. 的有利条件是
的有利条件是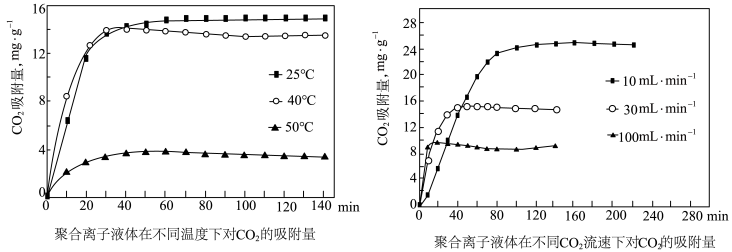
工业上以
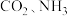 为原料生产尿素
为原料生产尿素 ,该反应分为二步进行:
,该反应分为二步进行:第一步:
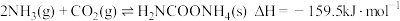
第二步:
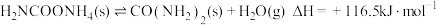
①写出上述合成尿素的热化学方程式
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入
 和
和 ,实验测得反应中各组分物质的量随时间的变化如下图所示:
,实验测得反应中各组分物质的量随时间的变化如下图所示: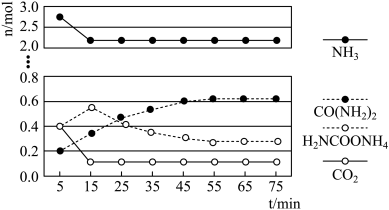
 时到达平衡.
时到达平衡.(4)合成乙酸:
中国科学家首次以
 和
和 为原料高效合成乙酸,其反应路径如下图所示:
为原料高效合成乙酸,其反应路径如下图所示: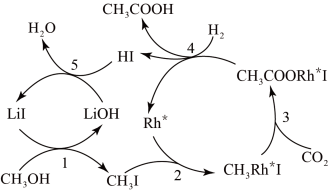
您最近半年使用:0次
名校
10 . 温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。
(1)在催化作用下由 和
和 转化为
转化为 的反应历程示意图如下图。
的反应历程示意图如下图。

在合成 的反应历程中,下列有关说法正确的是
的反应历程中,下列有关说法正确的是___________ (填字母)。
a.该催化剂使反应的平衡常数增大
b. 过程中,有
过程中,有 键断裂和
键断裂和 键形成
键形成
c.生成乙酸的反应原子利用率等于100%
d.
(2)以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
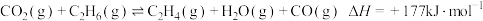 (主反应)
(主反应)
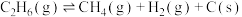
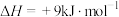 (副反应)
(副反应)
①主反应的反应历程可分为如下两步,反应过程中能量变化如图所示:

i.

ii.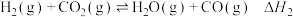

___________ ,主反应的决速步骤为___________ (填“反应i”或“反应ii”)。
②向恒压密闭容器中充入 和
和 ,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是___________ 。
 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。(1)在催化作用下由
 和
和 转化为
转化为 的反应历程示意图如下图。
的反应历程示意图如下图。
在合成
 的反应历程中,下列有关说法正确的是
的反应历程中,下列有关说法正确的是a.该催化剂使反应的平衡常数增大
b.
 过程中,有
过程中,有 键断裂和
键断裂和 键形成
键形成c.生成乙酸的反应原子利用率等于100%
d.

(2)以
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下: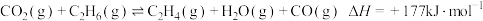 (主反应)
(主反应)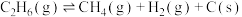
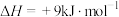 (副反应)
(副反应)①主反应的反应历程可分为如下两步,反应过程中能量变化如图所示:

i.


ii.
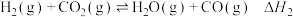

②向恒压密闭容器中充入
 和
和 ,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
您最近半年使用:0次



