名校
解题方法
1 . 丙烯是重要的有机合成原料。由丙烷制备丙烯是近年研究的热点,主要涉及如下反应:
反应 i:2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) △H1=-235 kJ·mol-1
2C3H6(g)+2H2O(g) △H1=-235 kJ·mol-1
反应 ii:2C3H8(g)+7O2(g) 6CO(g)+8H2O(g) △H2=-2742 kJ·mol-1
6CO(g)+8H2O(g) △H2=-2742 kJ·mol-1
回答下列问题:
(1)反应:2C3H6(g)+6O2(g) 6CO(g)+6H2O(g) △H3=
6CO(g)+6H2O(g) △H3=________ 。
(2)在刚性绝热容器中发生反应 i,下列能说明已达到平衡状态的有_______(填标号)。
(3)在压强恒定为 100 kPa 条件下,按起始投料n(C3H8)∶n(O2)=2∶1,匀速通入装有催化剂的反应器中发生反应 i 和反应 ii,其中不同温度下丙烷和氧气的转化率如图所示。

①曲线_______ (填“L1”或“L2”)表示丙烷的转化率。
②温度高于 T1 K 后曲线 L2随温度升高而降低的原因为_______ 。
③当温度高于_______ (填“T1”或“T2”)时,可判断反应 ii 不再发生,a 点对应的温度下,丙烯的分压 p(C3H6)=_______ kPa(保留 3 位有效数字,下同),反应i的标准平衡常数 K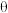 =
=_______ (已知:分压=总压×该组分物质的量分数,对于反应:dD(g)+eE(g)  gG(g)+hH(g),K
gG(g)+hH(g),K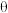 =
=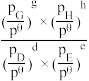 ;其中 p
;其中 p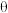 =100 kPa ,pG、pH、pD、pE为各组分的平衡分压)。
=100 kPa ,pG、pH、pD、pE为各组分的平衡分压)。
反应 i:2C3H8(g)+O2(g)
 2C3H6(g)+2H2O(g) △H1=-235 kJ·mol-1
2C3H6(g)+2H2O(g) △H1=-235 kJ·mol-1反应 ii:2C3H8(g)+7O2(g)
 6CO(g)+8H2O(g) △H2=-2742 kJ·mol-1
6CO(g)+8H2O(g) △H2=-2742 kJ·mol-1回答下列问题:
(1)反应:2C3H6(g)+6O2(g)
 6CO(g)+6H2O(g) △H3=
6CO(g)+6H2O(g) △H3=(2)在刚性绝热容器中发生反应 i,下列能说明已达到平衡状态的有_______(填标号)。
| A.每断裂 1 mol O=O 键,同时生成4molO-H 键 |
| B.容器内温度不再变化 |
| C.混合气体的密度不再变化 |
| D.n(C3H8)=n(C3H6) |

①曲线
②温度高于 T1 K 后曲线 L2随温度升高而降低的原因为
③当温度高于
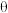 =
= gG(g)+hH(g),K
gG(g)+hH(g),K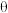 =
=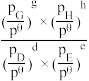 ;其中 p
;其中 p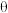 =100 kPa ,pG、pH、pD、pE为各组分的平衡分压)。
=100 kPa ,pG、pH、pD、pE为各组分的平衡分压)。
您最近一年使用:0次
2 . 甲醇是重要的化工原料,广泛应用于有机合成、医药生产等领域。在一定条件下,用 和
和 可以合成甲醇,这对于减少
可以合成甲醇,这对于减少 排放,实现“碳中和”具有重要意义。以
排放,实现“碳中和”具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
Ⅰ.
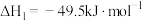
Ⅱ.

(1)已知:
 ,则反应Ⅱ的
,则反应Ⅱ的
___________ 。
(2) 和
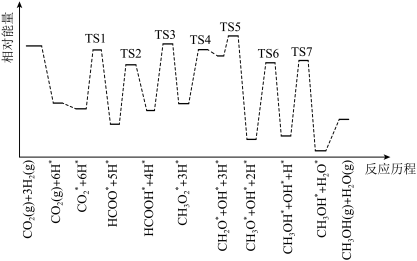
和 在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
①气体在催化剂表面的吸附是___________ (填“吸热”或“放热”)过程。
②该反应历程中反应速率最快步骤的化学方程式为___________ 。
(3)往恒容密闭容器中按 充入
充入 和
和 ,在催化剂作用下合成甲醇,
,在催化剂作用下合成甲醇, 平衡转化率和
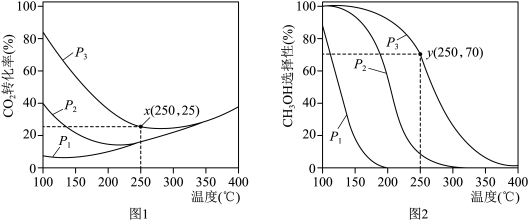
平衡转化率和 选择性随温度和压强的变化情况如图1、图2所示。
选择性随温度和压强的变化情况如图1、图2所示。
已知: 的选择性
的选择性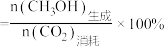
①据图可知,压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是___________ 。
②图2中 选择性随温度变化的原因是
选择性随温度变化的原因是___________ 。
③当温度为250℃、压强为 时,
时, 平衡转化率和
平衡转化率和 选择性如图中
选择性如图中 和
和 点所示。若平衡时容器内
点所示。若平衡时容器内 ,则反应I的平衡常数
,则反应I的平衡常数
___________ (列计算式)。
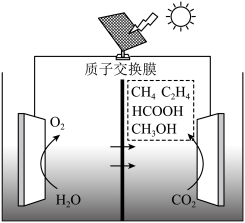
(4)目前,科研人员在研究 光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为___________ 。
 和
和 可以合成甲醇,这对于减少
可以合成甲醇,这对于减少 排放,实现“碳中和”具有重要意义。以
排放,实现“碳中和”具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):Ⅰ.

Ⅱ.


(1)已知:

 ,则反应Ⅱ的
,则反应Ⅱ的
(2)
 和
和 在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。①气体在催化剂表面的吸附是
②该反应历程中反应速率最快步骤的化学方程式为

(3)往恒容密闭容器中按
 充入
充入 和
和 ,在催化剂作用下合成甲醇,
,在催化剂作用下合成甲醇, 平衡转化率和
平衡转化率和 选择性随温度和压强的变化情况如图1、图2所示。
选择性随温度和压强的变化情况如图1、图2所示。
已知:
 的选择性
的选择性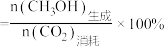
①据图可知,压强
 、
、 、
、 由小到大的顺序是
由小到大的顺序是②图2中
 选择性随温度变化的原因是
选择性随温度变化的原因是③当温度为250℃、压强为
 时,
时, 平衡转化率和
平衡转化率和 选择性如图中
选择性如图中 和
和 点所示。若平衡时容器内
点所示。若平衡时容器内 ,则反应I的平衡常数
,则反应I的平衡常数
(4)目前,科研人员在研究
 光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
您最近一年使用:0次
2022-03-09更新
|
453次组卷
|
2卷引用:福建省漳州市2022届高三毕业班第二次教学质量检测化学试题
解题方法
3 . 合成氨工业结束了人类依靠天然氮肥的历史,解决了人类的粮食问题。氨气广泛应用于化肥、制药、合成纤维等领域,极大地影响了人类的发展历史。
(1)以 与
与 为原料合成尿素[CO(NH2)2]的主要反应如下:
为原料合成尿素[CO(NH2)2]的主要反应如下:
①
②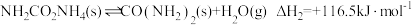
写出 与
与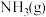 合成尿素和水蒸气的热化学反应方程式
合成尿素和水蒸气的热化学反应方程式___________ 。
(2)工业合成氨的反应原理为 。
。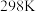 时该反应的能量变化如图1所示,图中曲线
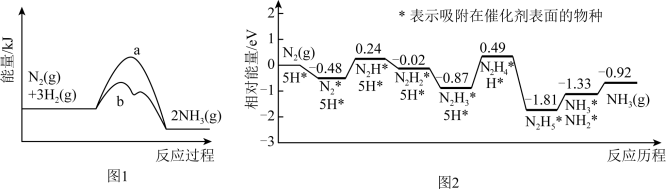
时该反应的能量变化如图1所示,图中曲线___________ (填字母)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原因是___________ 。科学工作者发现一种优良的合成氨催化剂——担载单原子钼的缺陷硼氮单层材料,反应的部分历程如图2所示,则该反应历程中需要吸收能量的最大能垒(活化能)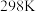
___________  ,对应步骤的化学方程式为
,对应步骤的化学方程式为___________ 。
(3)在实际生产中,合成氨工艺常用条件为铁触媒作催化剂、控制温度 、压强
、压强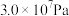 ,原料中N2和H2的物质的量之比为1∶2.8.下列关于合成氨工艺的叙述,正确的是
,原料中N2和H2的物质的量之比为1∶2.8.下列关于合成氨工艺的叙述,正确的是___________ (填字母)。
a.平衡后再通入N2,当重新达到平衡时,N2在混合气中的体积分数减小
b.控制温度(500℃)远高于室温,是为了保证尽可能高的平衡转化率和较快的反应速率
c.分离空气得到的N2须净化处理,以防止催化剂活性降低
d.原料气中N2过量,是因为N2相对易得,适度过量有利于提高H2的转化率
(4)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入 和
和 ,加入合适催化剂(体积可以忽略不计)后在一定温度和压强下开始反应,并用压力计检测容器内压强随反应时间的变化如下:
,加入合适催化剂(体积可以忽略不计)后在一定温度和压强下开始反应,并用压力计检测容器内压强随反应时间的变化如下:
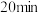 时,该反应
时,该反应
_______  (填“>”、“=”或“<”),该反应的平衡常数表达式K=
(填“>”、“=”或“<”),该反应的平衡常数表达式K=_______ 。从反应开始到25min时,用H2表示的平均反应速率
_______ 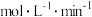 。
。
(1)以
 与
与 为原料合成尿素[CO(NH2)2]的主要反应如下:
为原料合成尿素[CO(NH2)2]的主要反应如下:①

②
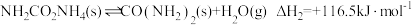
写出
 与
与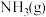 合成尿素和水蒸气的热化学反应方程式
合成尿素和水蒸气的热化学反应方程式(2)工业合成氨的反应原理为
 。
。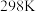 时该反应的能量变化如图1所示,图中曲线
时该反应的能量变化如图1所示,图中曲线
 ,对应步骤的化学方程式为
,对应步骤的化学方程式为
(3)在实际生产中,合成氨工艺常用条件为铁触媒作催化剂、控制温度
 、压强
、压强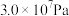 ,原料中N2和H2的物质的量之比为1∶2.8.下列关于合成氨工艺的叙述,正确的是
,原料中N2和H2的物质的量之比为1∶2.8.下列关于合成氨工艺的叙述,正确的是a.平衡后再通入N2,当重新达到平衡时,N2在混合气中的体积分数减小
b.控制温度(500℃)远高于室温,是为了保证尽可能高的平衡转化率和较快的反应速率
c.分离空气得到的N2须净化处理,以防止催化剂活性降低
d.原料气中N2过量,是因为N2相对易得,适度过量有利于提高H2的转化率
(4)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入
 和
和 ,加入合适催化剂(体积可以忽略不计)后在一定温度和压强下开始反应,并用压力计检测容器内压强随反应时间的变化如下:
,加入合适催化剂(体积可以忽略不计)后在一定温度和压强下开始反应,并用压力计检测容器内压强随反应时间的变化如下:反应时间/ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/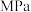 | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
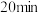 时,该反应
时,该反应
 (填“>”、“=”或“<”),该反应的平衡常数表达式K=
(填“>”、“=”或“<”),该反应的平衡常数表达式K=
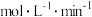 。
。
您最近一年使用:0次
名校
解题方法
4 . (1)下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
反应2H2(g)+O2(g)=2H2O(g)是__ (填“吸热”或“放热”)反应,这说明2molH2(g)和1mol O2(g)具有的能量比2mol H2O(g)具有的能量__ (填“高”或“低”)。
(2)氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
已知:N2(g)+O2(g)=2NO(g) △H1 =+180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=﹣393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=﹣221 kJ/mol
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___ 。
(3)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,已知图中E1=134kJ·mol-1、E2=368kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是__ (填“增大”“减小”或“不变”,下同),ΔH的变化是__ 。请写出NO2和CO反应的热化学方程式:__ 。

(4)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式:__ 。
| 物质 | H2(g) | O2(g) | H2O(g) |
| 能量 | 436 | 496 | 926 |
(2)氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
已知:N2(g)+O2(g)=2NO(g) △H1 =+180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=﹣393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=﹣221 kJ/mol
若某反应的平衡常数表达式为:K=
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(3)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,已知图中E1=134kJ·mol-1、E2=368kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是

(4)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式:
您最近一年使用:0次
5 . 氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
①分析数据可知:大气固氮反应属于_____ (填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因_____ 。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO +NO
+NO +
+_____ =Mn2++NO +H2O。
+H2O。
(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比) = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
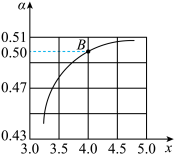
其它条件不变时,α随着x增大而增大的原因是____ ;图中的B点处NH3的平衡转化率为____ 。
II.(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为________ 。
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=___ (用n表示)。
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成__ 沉淀(填化学式);当测得溶液中钙离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c = ______ mol·L-1。(已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。)
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO
 +NO
+NO +
+ +H2O。
+H2O。(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比) = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
其它条件不变时,α随着x增大而增大的原因是
II.(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成
您最近一年使用:0次
解题方法
6 . 含氮化合物的研发与绿色反展、经济可持续发展有着密切关联。
(1)氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。
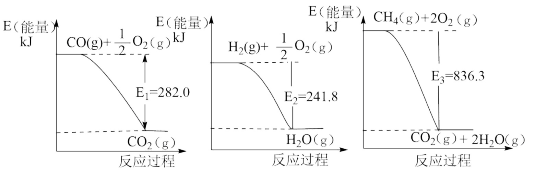
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:_______ 。
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g) N2O4(g)。
N2O4(g)。
每隔一定时间测定容器内各物质的物质的量,数据如下表:
①当反应在1500C达到平衡时,该反应平衡常数K=________ 。(填数值)
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为_______ 。
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物_______ g。
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)==CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:①b应控制在________ ;
A.1.5. 1.6 B.1~1.1 C.0.6~0.7
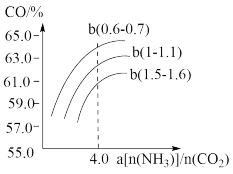
②a应控制在4.0的理由是_______ 。
(1)氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。

则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)
 N2O4(g)。
N2O4(g)。每隔一定时间测定容器内各物质的物质的量,数据如下表:
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在1500C达到平衡时,该反应平衡常数K=
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)==CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:①b应控制在
A.1.5. 1.6 B.1~1.1 C.0.6~0.7

②a应控制在4.0的理由是
您最近一年使用:0次



