1 . 我国提出“碳达峰”目标是在2030年前达到最高值,2060年前达到“碳中和”。因此,二氧化碳的综合利用尤为重要。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应I: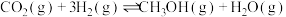
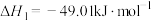
反应Ⅱ: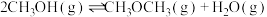
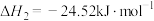
反应Ⅲ:
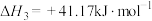
①结合计算分析反应 的自发性:
的自发性:_____ 。
②恒压、投料比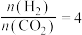 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
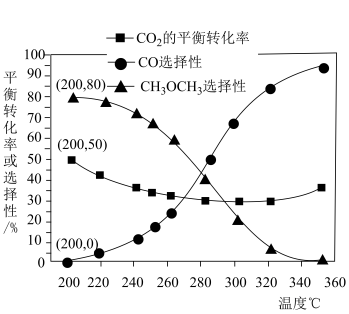
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是_____ 。
③工业实际设计温度一般在230∼270℃范围内变化,不能过高的原因是_____ 。
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。
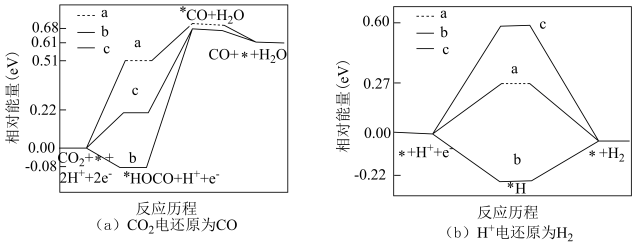
①CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_____ 。
②在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为_____ (用a、b、c字母排序)。
(3)CO2参与的乙苯脱氢机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。
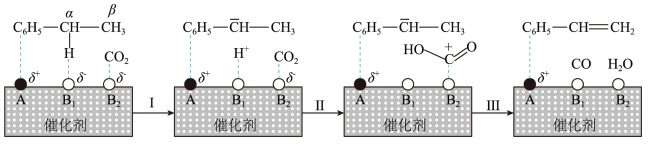
图中所示反应机理中步骤I可描述为:乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;步骤Ⅱ可描述为:_____ 。
(1)通过使用不同新型催化剂,实现二氧化碳加氢合成转化为二甲醚(CH3OCH3)也有广泛的应用。
反应I:
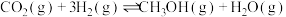
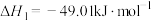
反应Ⅱ:
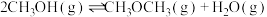
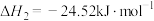
反应Ⅲ:

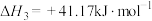
①结合计算分析反应
 的自发性:
的自发性:②恒压、投料比
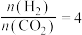 的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
的情况下,不同温度下CO2的平衡转化率和产物的选择性(选择性是指生成某物质消耗的CO2占CO2消耗总量的百分比)如下图所示:
当温度超过290℃,CO2的平衡转化率随温度升高而增大的原因是
③工业实际设计温度一般在230∼270℃范围内变化,不能过高的原因是
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。
①CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
②在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为

(3)CO2参与的乙苯脱氢机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。

图中所示反应机理中步骤I可描述为:乙苯α-H带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上;步骤Ⅱ可描述为:
您最近一年使用:0次
2 . 碳汇是指通过植树造林、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳,从而减少温室气体在大气中浓度的过程、活动或机制。已知利用植物的光合作用每吸收1molCO2需要吸收的能量约为470 kJ。请回答下列问题:
(1)碳汇过程中能量的转化形式为___________ 能转化为___________ 能;有资料表明,某块林木通过光合作用大约吸收了1.88×107 kJ能量,则吸收的CO2物质的量为___________ mol;CO2与液态水光合作用生成葡萄糖(C6H12O6)固体和氧气的热化学方程式为___________ 。
(2)工业废气中的CO2可用碱液吸收。已知:
①CO2(g) + NaOH(aq) = NaHCO3(aq) ΔH=-a kJ·mol-1;
②CO2(g) + 2NaOH(aq) = Na2CO3(aq) + H2O(l) ΔH=-b kJ·mol-1。
反应CO2(g) + H2O(l) + Na2CO3(aq) = 2NaHCO3(aq)的 =
=___________ kJ/mol(用含a、b的代数式表示)。
(3)利用工业废气中的CO2、H2为原料合成甲醇(CH3OH),已知298K时,每转化1mol CO2生成CH3OH(g)和水蒸气放出49.0 kJ热量,请写出该反应的热化学方程式___________ ;研究发现以二氧化碳和氢气为原料合成甲醇时,通常伴随着以下反应:
I.CO2(g)+H2(g)=CO(g)+H2O(g) △H= +41.2 kJ∙mol−1
II.CO(g)+2H2(g)=CH3OH(g) △H3
请应用盖斯定律计算△H3=___________ kJ∙mol−1。
(1)碳汇过程中能量的转化形式为
(2)工业废气中的CO2可用碱液吸收。已知:
①CO2(g) + NaOH(aq) = NaHCO3(aq) ΔH=-a kJ·mol-1;
②CO2(g) + 2NaOH(aq) = Na2CO3(aq) + H2O(l) ΔH=-b kJ·mol-1。
反应CO2(g) + H2O(l) + Na2CO3(aq) = 2NaHCO3(aq)的
 =
=(3)利用工业废气中的CO2、H2为原料合成甲醇(CH3OH),已知298K时,每转化1mol CO2生成CH3OH(g)和水蒸气放出49.0 kJ热量,请写出该反应的热化学方程式
I.CO2(g)+H2(g)=CO(g)+H2O(g) △H= +41.2 kJ∙mol−1
II.CO(g)+2H2(g)=CH3OH(g) △H3
请应用盖斯定律计算△H3=
您最近一年使用:0次
3 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
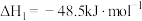
Ⅱ.
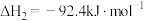
Ⅲ.
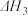
回答下列问题:
(1)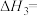
_________  。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2(g)的浓度为__________ mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________ 。
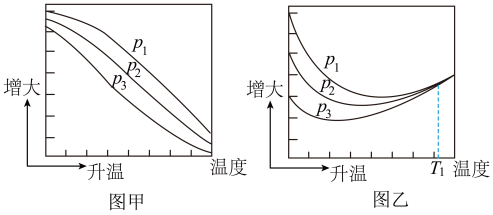
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。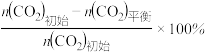
CH3OH的平衡产率=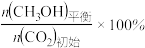
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________ (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
Ⅰ.

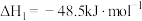
Ⅱ.

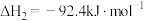
Ⅲ.

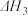
回答下列问题:
(1)
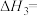
 。
。(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
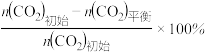
CH3OH的平衡产率=
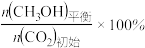
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
您最近一年使用:0次
2020-07-11更新
|
10959次组卷
|
23卷引用:福建省宁德市2020-2021学年高二上学期期末考试化学试题
福建省宁德市2020-2021学年高二上学期期末考试化学试题2020年山东省高考化学试卷(新高考)(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编西藏自治区拉萨市拉萨中学2021届高三第一次月考理综化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题江苏省扬州中学2020-2021学年高二下学期开学检测化学试题四川省邻水实验学校2021届高三下学期3月开学考试理综化学试题(已下线)重点9 化学反应原理的综合应用-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点8 化学反应原理的综合应用-2021年高考化学专练【热点·重点·难点】(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)湖南省长沙市第一中学2020-2021学年高二上学期入学考试化学试题(已下线)专题15 化学反应原理综合-备战2022年高考化学真题及地市好题专项集训【山东专用】山西省长治市第二中学校2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二上学期期中考试化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)2020年山东卷化学高考真题变式题16-20(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)第20讲 化学平衡常数及转化率的计算(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省武汉市常青联合体2022-2023学年高二上学期期中考试化学试题(已下线)专题17 原理综合题
4 . 氢氰酸(HCN)是一种具有苦杏仁气味的无色液体,易溶于水。回答下列问题:
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为______________ 。
②合成氢氰酸的化学方程式为________ 。
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
25 ℃时,物质的量浓度均为0.1 mol • L-1的NaCN、NaHCO3和Na2CO3三种溶液,其pH最大的是________ (填化学式)。
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=__________ (用△H1、△H2表示)。
②对于反应Ⅱ,减小压强,HCN的转化率______ (填“提高”、“不变”或“降低”)。
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=_________ 。
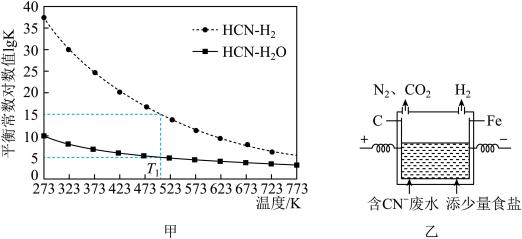
(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为________________ 。
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为
②合成氢氰酸的化学方程式为
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
| 物质 | 电离常数(Ka) |
| HCN | Ka=5×10-10 |
| H2CO3 | Ka1=4. 5×10-7 Ka2=4.7×10-11 |
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=
②对于反应Ⅱ,减小压强,HCN的转化率
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=

(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为
您最近一年使用:0次



