西藏自治区拉萨市拉萨中学2021届高三第一次月考理综化学试题
西藏
高三
阶段练习
2020-09-30
294次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、化学反应原理、物质结构与性质、有机化学基础
西藏自治区拉萨市拉萨中学2021届高三第一次月考理综化学试题
西藏
高三
阶段练习
2020-09-30
294次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、化学反应原理、物质结构与性质、有机化学基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 化学与资源、环境、生活密切相关,下列说法正确的是
| A.煤经气化和液化两个化学变化过程,可变为洁净燃料 |
| B.从海水中提取物质都必须通过化学反应才能实现 |
| C.二氧化硫具有漂白性,常用于纸张、食品的增白 |
| D.绿色化学的核心是应用化学原理对环境污染进行治理 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
2. NA代表阿伏加 德罗常数的值。下列说法错误的是( )
| A.密闭容器中,2molSO2和1molO2催化反应后分子总数大于2NA |
| B.1LpH=2的H2SO3溶液中含H+的数目为0.01NA |
| C.5.6g铁与稀硝酸反应生成0.08molNO,转移电子数为0.3NA |
| D.6.4 g S2和S8的混合物中所含硫原子数为0.2 NA |
您最近一年使用:0次
2020-04-10更新
|
254次组卷
|
2卷引用:陕西省西安中学2020届高三第一次模拟考试化学试题
单选题
|
适中(0.65)
名校
3. 利用下列实验装置能达到实验目的的是
A. 分离CH3COOH和CH3COOC2H5混合液 分离CH3COOH和CH3COOC2H5混合液 |
B. 验证NH4NO3晶体溶于水的热效应 验证NH4NO3晶体溶于水的热效应 |
C. 蒸发FeCl3溶液得到FeCl3固体 蒸发FeCl3溶液得到FeCl3固体 |
D. 验证C、Cl、Si的非金属性强弱 验证C、Cl、Si的非金属性强弱 |
您最近一年使用:0次
2019-04-09更新
|
613次组卷
|
5卷引用:【市级联考】云南省昆明市2019届高三下学期4月复习教学质量检测理科综合化学试题
单选题
|
较易(0.85)
名校
解题方法
4. 下列离子方程式表达正确的是
A.向FeC13溶液中滴加HI溶液: |
B.向(NH4)2SO4溶液中滴加Ba(OH)2溶液:  ↓ ↓ |
C.Ca(OH)2溶液与少量NaHCO3溶液混合: |
D.3mol/LNa2CO3溶液和1mol/L Al2(SO4)3溶液等体积混合: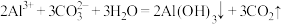 |
【知识点】 离子方程式的正误判断解读
您最近一年使用:0次
2020-02-15更新
|
435次组卷
|
3卷引用:安徽省合肥市2020届高三第一次教学质量检测化学试题
单选题
|
适中(0.65)
名校
解题方法
5. “重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是


A.O2在b极得电子,最终被还原为 |
| B.放电过程中,电子由电极a经导线流向电极b |
C.该电池工作时, 经“交换膜2”移向b极 经“交换膜2”移向b极 |
D.H2参与的电极反应为: |
【知识点】 燃料电池
您最近一年使用:0次
2019-11-27更新
|
894次组卷
|
7卷引用:浙江省嘉兴市第一中学、湖州中学2019-2020学年高二上学期期中联考化学试题
浙江省嘉兴市第一中学、湖州中学2019-2020学年高二上学期期中联考化学试题(已下线)2019年11月27日 《每日一题》人教版(选修4)——氢氧燃料电池浙江省磐安县第二中学2019-2020学年高二上学期期中考试化学试题四川省绵阳市三台中学实验学校2019-2020学年高二下学期6月月考化学试题西藏自治区拉萨市拉萨中学2021届高三第一次月考理综化学试题黑龙江省绥化市一中2020-2021学年度高二上学期第三次月考化学试题(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
单选题
|
适中(0.65)
名校
6. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可与其最高价氧化物的水化物反应生成盐,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。下列说法正确的是
| A.W、X、Y、Z的简单离子的半径依次增大 |
| B.X的简单氢化物的热稳定性比W的强 |
| C.析出的黄色沉淀易溶于乙醇 |
| D.X与Z属于同一主族,X与Y属于同一周期 |
您最近一年使用:0次
2019-01-27更新
|
494次组卷
|
8卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
单选题
|
较难(0.4)
7. 常温下向一定浓度的Na2X溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:H2X是二元弱酸,Y表示 或
或 ,pY=-lgY。下列叙述错误的是
,pY=-lgY。下列叙述错误的是
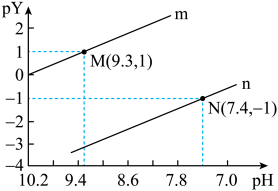
 或
或 ,pY=-lgY。下列叙述错误的是
,pY=-lgY。下列叙述错误的是
A.曲线n表示 与pH的变化关系 与pH的变化关系 |
| B.Ka1(H2X)=1.0×10-10.3 |
| C.NaHX溶液中c(OH-)>c(H+) |
| D.当pH=7时,混合溶液中c(Na+)=c(HX-)+2c(X2-)+c(Cl-) |
您最近一年使用:0次
2020-06-06更新
|
943次组卷
|
8卷引用:安徽省皖南八校2020届高三临门一卷理综化学试题
安徽省皖南八校2020届高三临门一卷理综化学试题(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编西藏自治区拉萨市拉萨中学2021届高三第一次月考理综化学试题陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期5月半月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第51练 反应过程溶液粒子浓度变化的图像分析甘肃省嘉峪关市等3地2022-2023学年高二上学期12月期末化学试题
二、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
8. 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
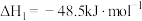
Ⅱ.
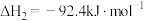
Ⅲ.
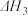
回答下列问题:
(1)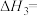
_________  。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2(g)的浓度为__________ mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________ 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。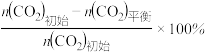
CH3OH的平衡产率=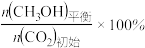
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________ (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
Ⅰ.

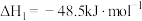
Ⅱ.

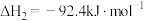
Ⅲ.

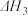
回答下列问题:
(1)
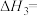
 。
。(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
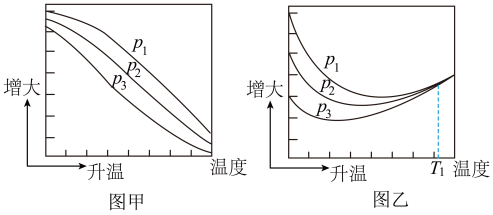
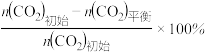
CH3OH的平衡产率=
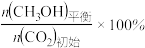
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
您最近一年使用:0次
2020-07-11更新
|
10986次组卷
|
23卷引用:2020年山东省高考化学试卷(新高考)
2020年山东省高考化学试卷(新高考)(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编西藏自治区拉萨市拉萨中学2021届高三第一次月考理综化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题福建省宁德市2020-2021学年高二上学期期末考试化学试题江苏省扬州中学2020-2021学年高二下学期开学检测化学试题四川省邻水实验学校2021届高三下学期3月开学考试理综化学试题(已下线)重点9 化学反应原理的综合应用-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点8 化学反应原理的综合应用-2021年高考化学专练【热点·重点·难点】(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)湖南省长沙市第一中学2020-2021学年高二上学期入学考试化学试题(已下线)专题15 化学反应原理综合-备战2022年高考化学真题及地市好题专项集训【山东专用】山西省长治市第二中学校2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二上学期期中考试化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)2020年山东卷化学高考真题变式题16-20(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)第20讲 化学平衡常数及转化率的计算(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省武汉市常青联合体2022-2023学年高二上学期期中考试化学试题(已下线)专题17 原理综合题
解答题-工业流程题
|
较难(0.4)
名校
9. 无机研究开创绝不无“钴”的时代,例如:CoCl2·6H2O是一种饲料营养强化剂、草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:
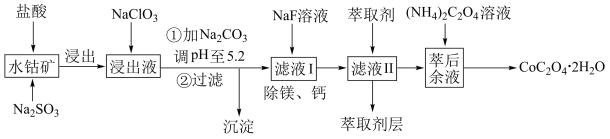
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
(1)浸出过程中加入Na2SO3的主要离子方程式为____________________ 。
(2)加入 NaClO3发生可以将溶液中Fe2+氧化,进而调节pH除去,但不能向“浸出液”中加过量 NaClO3的主要原因是:__________________ 。
(3)若“滤液Ⅰ”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___________ mol/L。[已知Ksp(CaF2)=4.0×10-11]
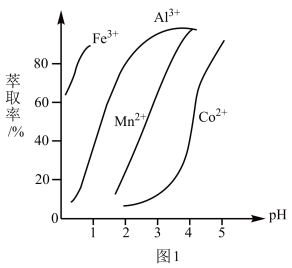
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是___________ ;其使用的适宜pH范围是___________ (填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;用化学方程式表示从A点到B点的物质转化___________ 。C点所示产物的化学式是___________ 。(Co的相对原子质量是59)

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
(1)浸出过程中加入Na2SO3的主要离子方程式为
(2)加入 NaClO3发生可以将溶液中Fe2+氧化,进而调节pH除去,但不能向“浸出液”中加过量 NaClO3的主要原因是:
(3)若“滤液Ⅰ”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5


(5)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;用化学方程式表示从A点到B点的物质转化
您最近一年使用:0次
2019-03-03更新
|
956次组卷
|
3卷引用:【市级联考】贵州省安顺市普通高中2019届高三上学期期末考试理科综合化学试题
解答题-实验探究题
|
较难(0.4)
名校
10. 人教版高中化学选修4实验2-3中用到了硫代硫酸钠,某化学兴趣小组对这一物质展开了如下探究。

实验一.制备Na2S2O3·5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l);S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
(1)写出A中的化学反应方程式___________________________________ 。
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有_________________________ (写一条)。
(3)装置E的作用是____________________ 。
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_________________________ 。
实验二.性质探究
(5)常温下,用pH试纸测定0.1mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_______________________________________________________ 。
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式________________________________________ 。
实验三.Na2S2O3的应用
(7)用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
部分反应的离子方程式为:
① Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O
② I2+2S2O32-=S4O62-+2I-
滴定时Na2S2O3标准溶液应该用_____________________ (填仪器名称) 盛装,该废水中Ba2+的物质的量浓度为_______________________ 。

实验一.制备Na2S2O3·5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l);S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq)(1)写出A中的化学反应方程式
(2)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有
(3)装置E的作用是
(4)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为
实验二.性质探究
(5)常温下,用pH试纸测定0.1mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是
(6)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式
实验三.Na2S2O3的应用
(7)用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 20.03 | 17.98 | 18.00 |
① Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O
② I2+2S2O32-=S4O62-+2I-
滴定时Na2S2O3标准溶液应该用
您最近一年使用:0次
2018-05-13更新
|
841次组卷
|
3卷引用:【全国市级联考】重庆市2018届高三第二次诊断考试理科综合化学试题
解答题-结构与性质
|
适中(0.65)
名校
11. 氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是________ 。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是________ ,中心原子的杂化方式为________ 。NaBH4中存在________ (填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为_________ 。
(4)第三周期元素氟化物的熔点如下表:
解释表中氟化物熔点变化的原因:________ 。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加 德罗常数的值为NA,则CaF2的密度ρ=_______ g·cm-3(列出计算表达式)。

(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加 德罗常数的值为NA,则CaF2的密度ρ=

【知识点】 物质结构与性质综合考查解读
您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
名校
解题方法
12. 化合物F具有独特的生理药理作用,实验室由芳香化合物A制备下的一种合成路线如下:

已知:①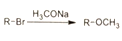
②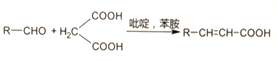
回答下列问题:
(1)A的名称为________ ,B生成C的反应类型为________ 。
(2)咖啡酸的结构简式为_______ 。
(3)F中含氧官能团名称为________ 。
(4)写出F与足量NaOH溶液反应的化学方程式_______
(5)G为香兰素的同分异构体,能使FeCl3溶液变紫色,苯环上只有两个取代基团,能发生水解反应,符合要求的同分异构体有______ 种,请写出其中核磁共振氢谱图显示有4种不同环境的氢,峰面积比为3:2:2:1的G的结构简式_________ 。
(6)写出以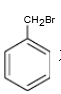 原料(其他试剂任选) 制备肉桂酸(
原料(其他试剂任选) 制备肉桂酸( )的合成路线。
)的合成路线。______________

已知:①

②

回答下列问题:
(1)A的名称为
(2)咖啡酸的结构简式为
(3)F中含氧官能团名称为
(4)写出F与足量NaOH溶液反应的化学方程式
(5)G为香兰素的同分异构体,能使FeCl3溶液变紫色,苯环上只有两个取代基团,能发生水解反应,符合要求的同分异构体有
(6)写出以
 原料(其他试剂任选) 制备肉桂酸(
原料(其他试剂任选) 制备肉桂酸( )的合成路线。
)的合成路线。
您最近一年使用:0次
2018-01-19更新
|
553次组卷
|
4卷引用:广东省佛山市普通高中2018届高三教学质量检测(一)化学试题
广东省佛山市普通高中2018届高三教学质量检测(一)化学试题【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题(已下线)2020年高考化学押题预测卷02(新课标Ⅱ卷)--《2020年高考押题预测卷》西藏自治区拉萨市拉萨中学2021届高三第一次月考理综化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、化学反应原理、物质结构与性质、有机化学基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 二氧化硫 绿色化学与可持续发展 煤的液化 海水资源综合利用 | |
| 2 | 0.85 | 阿伏加德罗常数的求算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 3 | 0.65 | 常见物质的制备 实验方案设计的基本要求 物质性质实验方案的设计 综合实验设计与评价 | |
| 4 | 0.85 | 离子方程式的正误判断 | |
| 5 | 0.65 | 燃料电池 | |
| 6 | 0.65 | 金属与非金属在周期表中位置及其性质递变的规律 “定位法”在推断中的应用 “位构性”关系理解及应用 | |
| 7 | 0.4 | 弱电解质的电离平衡 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.65 | 盖斯定律及其有关计算 化学平衡的移动及其影响因素 化学平衡常数的有关计算 与转化率变化有关图像的分析 | 原理综合题 |
| 9 | 0.4 | 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 物质制备的探究 | 工业流程题 |
| 10 | 0.4 | 含硫化合物之间的转化 二氧化硫的化学性质 物质含量的测定 物质制备的探究 | 实验探究题 |
| 11 | 0.65 | 物质结构与性质综合考查 | 结构与性质 |
| 12 | 0.65 | 有机反应类型 根据要求书写同分异构体 含酯基有机物水解消耗NaOH的量的计算 根据题给物质选择合适合成路线 | 有机推断题 |



