河北省承德第一中学2020届高三9月月考化学试题
河北
高三
阶段练习
2019-10-07
210次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、物质结构与性质、化学实验基础、化学反应原理、常见无机物及其应用
河北省承德第一中学2020届高三9月月考化学试题
河北
高三
阶段练习
2019-10-07
210次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、物质结构与性质、化学实验基础、化学反应原理、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 化学无处不在,下列有关说法不正确的是
| A.侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C.碘是人体必须的微量元素,所以每个人都要补碘 |
| D.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 |
您最近一年使用:0次
2019-01-27更新
|
178次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
2. NA代表阿伏加 德罗常数的值。下列说法正确的是
| A.常温常压下,124g P4中所含P-P键数目为4NA |
| B.1mol Fe溶于过量硝酸,电子转移数为3NA |
| C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为4NA |
| D.密闭容器中,2mol SO2和1mol O2催化反应后原子总数为8NA |
您最近一年使用:0次
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
3. 下列各离子组能大量共存的是
| A.澄清溶液中:Cu2+、NH4+、C1-、SO42- |
| B.常温下pH=1的溶液中:NO3-、K+、Na+、I- |
| C.在1mol·L-1的KMnO4酸性溶液中:K+、SO32-、SO42-、C1- |
| D.0.1mol/L的A1C13溶液中:Na+、HCO3-、NO3-、Fe2+ |
【知识点】 限定条件下的离子共存解读
您最近一年使用:0次
2019-01-27更新
|
122次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
单选题
|
适中(0.65)
名校
4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可与其最高价氧化物的水化物反应生成盐,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。下列说法正确的是
| A.W、X、Y、Z的简单离子的半径依次增大 |
| B.X的简单氢化物的热稳定性比W的强 |
| C.析出的黄色沉淀易溶于乙醇 |
| D.X与Z属于同一主族,X与Y属于同一周期 |
您最近一年使用:0次
2019-01-27更新
|
494次组卷
|
8卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
单选题
|
较难(0.4)
名校
5. 下列实验的现象和原因都正确的是
| 实验 | 现象 | 原因 | |
| A | 金属铝与少量氢氧化钠溶液反应 | 有白色氢氧化铝沉淀生成 | 氢氧化钠溶液量不足 |
| B | 金属铜加入浓硝酸中 | 产生使品红褪色的气体 | 生成SO2 |
| C | 将洁净的铜丝插入高温硫蒸气中 | 红色铜丝变黑 | 生成Cu2S |
| D | 向碳酸钠固体上滴加少量盐酸 | 无气体产生 | 生成碳酸氢钠 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-27更新
|
410次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
单选题
|
适中(0.65)
名校
6. KIO3可采用电解法制备,装置如图所示。下列叙述正确的是


| A.通电后阴极的电极反应式2H2O+2e-=2OH-+H2↑ |
| B.电解过程中通过阳离子交换膜的离子主要为K+,其迁移方向是从右到左 |
| C.电解过程中阳极附近pH增大 |
| D.当电路中通过1mol电子的电量时,会有0.5mol的KIO3生成 |
您最近一年使用:0次
2019-01-27更新
|
98次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
单选题
|
适中(0.65)
名校
7. CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+ O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+
 O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是| A.△H=2△H3-2△H2-△H1 |
| B.K=2K3-K2-K1 |
| C.若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2 |
| D.减小压强可增大CH4(g)和CO2(g)的平衡转化率 |
【知识点】 盖斯定律与热化学方程式解读 化学平衡常数的有关计算解读
您最近一年使用:0次
2019-01-27更新
|
254次组卷
|
5卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
四、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
名校
8. 钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________ 。
(2)写出NaClO3发生反应的主要离子方程式:______________________________ ;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________ ;萃取剂使用的最佳pH范围是__________ (填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________ 。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________ 。

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:
(2)写出NaClO3发生反应的主要离子方程式:
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为
【知识点】 离子反应的发生及书写 常见无机物的制备解读 物质制备的探究解读
您最近一年使用:0次
2019-01-27更新
|
364次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
解答题-无机推断题
|
适中(0.65)
名校
9. 部分中学化学常见元素原子结构及性质如表所示
(1)C元素在周期表中的位置_____________ ;E形成的一种简单离子能支持“将E排在VIIA族”这一观点,该离子的结构示意图为_______________________ 。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为________________________________ 。
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式__________________________ (用相应化学式表示)
(3)请画出化合物F2B2的电子式__________ ,该化合物中含有的化学键类型是_______ 。
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向_________ (填“A”或“C”),写出该原电池总反应的离子方程式____________________ 。
| 元素 | 结构及性质 |
| A | A在第三周期中简单离子半径最小 |
| B | B原子最外层电子数是内层电子数的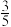 |
| C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
| D | D与B同主族,且通常状况下D没有正化合价 |
| E | E在周期表中位于IA族,有人认为将其排在VIIA族也有一定道理 |
| F | F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)C元素在周期表中的位置
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式
(3)请画出化合物F2B2的电子式
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向
您最近一年使用:0次
2019-01-27更新
|
418次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
解答题-实验探究题
|
适中(0.65)
名校
10. 水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
步骤1:制备NaClO溶液。已知:3NaClO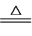 NaCl+NaClO3
NaCl+NaClO3
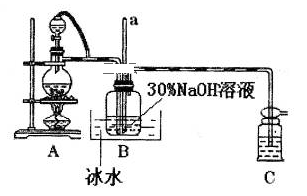
(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_______ (填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是__________ ;若装置C中出现堵塞,玻璃管a中的现象为_______________ ;B中用冰水浴控制温度在30℃以下,其主要目的是______________ 。
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl)。
(3)分液漏斗中的溶液是___________ (填“A”或“B”);
A.NaOH和NaClO混合溶液 B.CO(NH2)2溶液
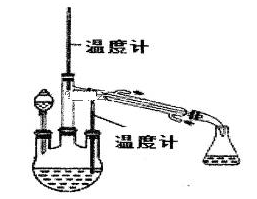
步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为_______________ 。
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为_______________________________________ ;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为__________ 。(保留三位有效数字)
步骤1:制备NaClO溶液。已知:3NaClO
 NaCl+NaClO3
NaCl+NaClO3
(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl)。
(3)分液漏斗中的溶液是
A.NaOH和NaClO混合溶液 B.CO(NH2)2溶液

步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为
【知识点】 离子反应的发生及书写 常见无机物的制备解读 物质含量的测定
您最近一年使用:0次
2019-01-27更新
|
167次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
11. 资源化利用CO具有重要意义。
(1)CO可设计成燃料电池,熔融Li2CO3和Na2CO3的混合物作为燃料电池的电解质,氧化剂是含CO2的O2,工作时正极反应为__________________ ,以该燃料电池为电源处理含氮氧化物废气,可回收硝酸,同时制得副产物氢气,装置如图所示(电极均为石墨电极)。该装置中应选用_______ (填“阴”或“阳”)离子交换膜,写出电解时NO2发生反应的电极反应式:___________________ 。

(2)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
试计算,试计算,X=_________ 。
T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应I,反应达到平衡后,在t1时刻改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是_____________________ 。
a.保持温度、体积不变,使用催化剂 b.保持体积不变,升高温度
c.保持温度不变,压缩容器体积 d.保持温度、体积不变,充入CO
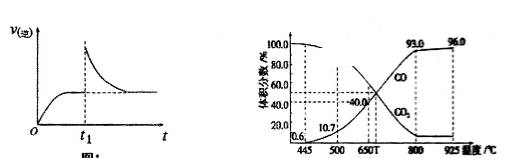
(3)在一定温度下,向某体积可变的恒压(P总)密闭容器中加入1mol CO2与足量的碳发生反应III,平衡时体系中气体体积分数与温度的关系如图所示。
①650℃时,反应达平衡后CO2的转化率为____________ 。
②T℃时,该反应达到平衡时下列说法不正确的是__________________ 。
a.气体密度保持不变
b.2v正(CO2)=v正(CO)
c.若保持其它条件不变再充入等体积的CO2和CO,平衡向逆反应方向移动
d.若保持其它条件不变再充入惰性气体,v正、v逆均减小,平衡不移动
e.若其它条件不变将容器体积压缩至一半并维持体积不变,再次达平衡时压强小于原平衡的2倍
③根据图中数据,计算反应III在T℃时用平衡分压代替平衡浓度表示的化学平衡常数KP=___________ (设总压强为P总,用含P总的代数式表示)
(1)CO可设计成燃料电池,熔融Li2CO3和Na2CO3的混合物作为燃料电池的电解质,氧化剂是含CO2的O2,工作时正极反应为

(2)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
| 反应 | △H(kJ/mol) |
I. Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) 2Fe(s)+3CO(g) | +489 |
II. Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) 2Fe(s)+3CO2(g) | -27 |
III. C(s)+CO2(g)  2CO(g) 2CO(g) | X |
试计算,试计算,X=
T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应I,反应达到平衡后,在t1时刻改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是
a.保持温度、体积不变,使用催化剂 b.保持体积不变,升高温度
c.保持温度不变,压缩容器体积 d.保持温度、体积不变,充入CO

(3)在一定温度下,向某体积可变的恒压(P总)密闭容器中加入1mol CO2与足量的碳发生反应III,平衡时体系中气体体积分数与温度的关系如图所示。
①650℃时,反应达平衡后CO2的转化率为
②T℃时,该反应达到平衡时下列说法不正确的是
a.气体密度保持不变
b.2v正(CO2)=v正(CO)
c.若保持其它条件不变再充入等体积的CO2和CO,平衡向逆反应方向移动
d.若保持其它条件不变再充入惰性气体,v正、v逆均减小,平衡不移动
e.若其它条件不变将容器体积压缩至一半并维持体积不变,再次达平衡时压强小于原平衡的2倍
③根据图中数据,计算反应III在T℃时用平衡分压代替平衡浓度表示的化学平衡常数KP=
您最近一年使用:0次
2019-01-27更新
|
219次组卷
|
2卷引用:山东省恒台第一中学2019届高三上学期诊断性考试理科综合化学试题
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、物质结构与性质、化学实验基础、化学反应原理、常见无机物及其应用
试卷题型(共 11题)
题型
数量
单选题
6
多选题
1
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 食品添加剂 大气污染 纯碱的生产 | |
| 3 | 0.65 | 限定条件下的离子共存 | |
| 4 | 0.65 | 金属与非金属在周期表中位置及其性质递变的规律 “定位法”在推断中的应用 “位构性”关系理解及应用 | |
| 5 | 0.4 | 物质检验和鉴别的基本方法选择及应用 化学实验方案的设计与评价 | |
| 6 | 0.65 | 电解原理的应用 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.65 | 盖斯定律与热化学方程式 化学平衡常数的有关计算 | |
| 二、多选题 | |||
| 2 | 0.65 | 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 三、解答题 | |||
| 8 | 0.4 | 离子反应的发生及书写 常见无机物的制备 物质制备的探究 | 工业流程题 |
| 9 | 0.65 | 硫化氢 铝与强碱溶液反应 原电池 元素周期律、元素周期表的推断 | 无机推断题 |
| 10 | 0.65 | 离子反应的发生及书写 常见无机物的制备 物质含量的测定 | 实验探究题 |
| 11 | 0.65 | 盖斯定律及其有关计算 化学平衡的移动及其影响因素 化学平衡常数的有关计算 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |



