1 . 丙烯是重要的有机合成原料。由丙烷制备丙烯是近年研究的热点,主要涉及如下反应:
反应Ⅰ:2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
反应Ⅱ:2C3H8(g)+7O2(g) 6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
回答下列问题:
(1)反应2C3H6(g)+6O2(g) 6CO(g)+6H2O(g)的ΔH=
6CO(g)+6H2O(g)的ΔH=___________ 。
(2)在刚性绝热容器中发生反应Ⅰ,下列叙述能说明反应已达到平衡状态的是___________(填标号)。
(3)在压强恒定为100 kPa条件下,将n(C3H8) n(O2)=2
n(O2)=2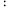 1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
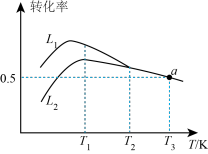
①曲线___________ (填“L1”或“L2”)表示丙烷的转化率。
②温度高于T1 K后曲线L2随温度升高而降低的原因为___________ 。
③当温度高于___________ (填“T1”或“T2”)时,反应Ⅱ不再发生,a点对应的温度下,丙烯的分压 p(C3H6) =___________ kPa(保留3位有效数字),反应I的标准平衡常数 Kθ=___________ (已知:分压=总压×该组分物质的量分数,对于反应:dD(g)+eE(g) gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ=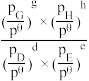 ;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
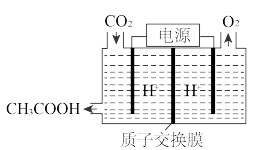
(4)在“碳中和”实施过程中,可将工业生产中产生的CO2气体通过如图所示的电解原理转化成重要的有机物,阴极的电极反应式为___________ 。
反应Ⅰ:2C3H8(g)+O2(g)
 2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1反应Ⅱ:2C3H8(g)+7O2(g)
 6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1回答下列问题:
(1)反应2C3H6(g)+6O2(g)
 6CO(g)+6H2O(g)的ΔH=
6CO(g)+6H2O(g)的ΔH=(2)在刚性绝热容器中发生反应Ⅰ,下列叙述能说明反应已达到平衡状态的是___________(填标号)。
| A.每断裂1 mol O=O键,同时生成4 mol O-H键 | B.容器内温度不再变化 |
| C.混合气体的密度不再变化 | D.n(C3H8) = n(C3H6) |
(3)在压强恒定为100 kPa条件下,将n(C3H8)
 n(O2)=2
n(O2)=2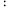 1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
①曲线
②温度高于T1 K后曲线L2随温度升高而降低的原因为
③当温度高于
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ=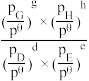 ;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。(4)在“碳中和”实施过程中,可将工业生产中产生的CO2气体通过如图所示的电解原理转化成重要的有机物,阴极的电极反应式为

您最近一年使用:0次
2 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)科学家们经过探索实践,建立了如图所示的CO2新循环体系:

根据上图分析,下列相关说法错误的是___________
(2)研究证明,CO2可作为合成甲烷的原料,已知:
①CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH=-41kJ·mol-1
②C(s)+2H2(g)⇌CH4(g) ΔH=-73kJ·mol-1
③2CO(g)⇌C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:___________ 。
(3)工业上有一种“降碳”方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________ ,平衡时CO2的转化率为___________ ,平衡时甲醇的体积分数=___________ 。
②下列措施可以增大CO2平衡转化率的是___________ 。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.扩大容器的容积
F.将水蒸气从体系中分离
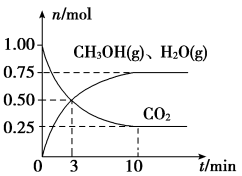
③一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点___________ (填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是___________ 。
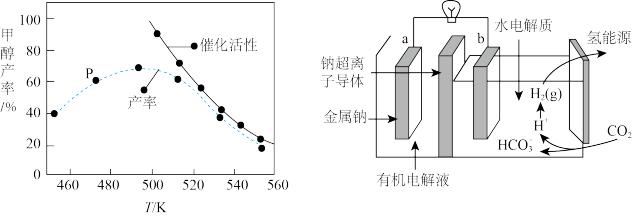
(4)碳排放是影响气候变化的重要因素之一、最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。
①系统工作时,有机电解液___________ (填“能”或“不能”)用含水·电解液替换。
②写出二氧化碳生成氢气的电极反应式___________ 。
(1)科学家们经过探索实践,建立了如图所示的CO2新循环体系:

根据上图分析,下列相关说法错误的是___________
| A.化学变化中质量和能量都是守恒的 |
| B.CO2和H2生成甲烷的反应中原子利用率为100% |
| C.将CO2还原为甲醇能有效促进“碳中和” |
| D.无机物和有机物可以相互转化 |
①CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH=-41kJ·mol-1
②C(s)+2H2(g)⇌CH4(g) ΔH=-73kJ·mol-1
③2CO(g)⇌C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(3)工业上有一种“降碳”方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施可以增大CO2平衡转化率的是
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.扩大容器的容积
F.将水蒸气从体系中分离
③一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点

(4)碳排放是影响气候变化的重要因素之一、最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。
①系统工作时,有机电解液
②写出二氧化碳生成氢气的电极反应式
您最近一年使用:0次
3 . Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________ 。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
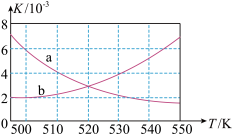
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________ (填曲线标记字母),其判断理由是____________ 。
(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
①0~20 min的平均反应速率v(CO)=__________________ mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________ ;
③在上述温度下,该反应的平衡常数K=______________________ ;
④能表明该反应达到平衡状态的是________ (填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________ 移动(填“向左”“向右”或“不”)。
已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+
 O2(g)=H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH2=-241.8 kJ·mol-1CO(g)+
 O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为

(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
| n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
②达到平衡时,H2的转化率为
③在上述温度下,该反应的平衡常数K=
④能表明该反应达到平衡状态的是
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡
您最近一年使用:0次
2019-06-28更新
|
535次组卷
|
4卷引用:福建省建瓯市芝华中学2020-2021学年高二上学期期中考试化学(选考班)试题



