名校
解题方法
1 . 以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:
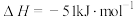
反应Ⅱ:
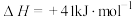
①已知几种化学键的键能如下表所示,则a=_____ kJ·mol-1.
②若反应Ⅱ逆反应活化能 ,则该反应的正反应的活化能
,则该反应的正反应的活化能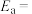
_____ kJ·mol-1.
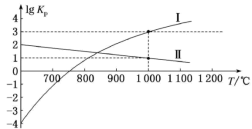
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数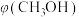 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中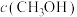 关系如图2所示:
关系如图2所示:
①图1中P1_____ P2(填“>”、“<”或“=”);
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是_____ (填字母序号)。 、
、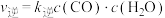 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是_____ ,表示lgk逆随温度T变化关系的直线是_____ 。
(4)已知一定温度下按照起始比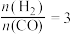 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
_____ MPa-2(保留2位有效数字)(各气体分压=平衡体系中各气体的体积分数×总压)。
(5)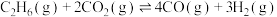
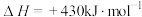 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:

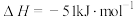
反应Ⅱ:

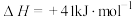
①已知几种化学键的键能如下表所示,则a=
| 化学键 | C—H | C—O | H—O | H—H | C≡O |
| 键能/kJ·mol-1 | 406 | 351 | 465 | 436 | a |
 ,则该反应的正反应的活化能
,则该反应的正反应的活化能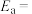
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数
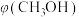 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中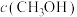 关系如图2所示:
关系如图2所示:①图1中P1
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是

 、
、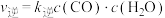 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是(4)已知一定温度下按照起始比
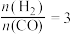 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
(5)
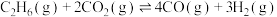
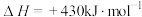 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。| A.恒温恒容容器 | B.恒容绝热容器 |
| C.恒压绝热容器 | D.恒温恒压容器 |
您最近一年使用:0次
名校
2 . 甲醚是重要的有机合成原料,甲醇制备甲醚的反应: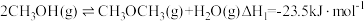 ;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
(1)CO2和H2在某催化剂表面合成CH3OH: ,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为
,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为___________ 。已知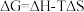 (△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是___________ (填代号)。
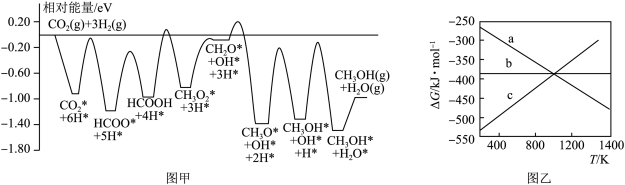
(2)CO催化加氢法合成CH3OH,进而制备CH3OCH3的过程中涉及如下反应:
反应I: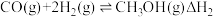
反应II: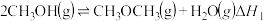
反应III: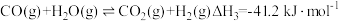
①在298K,101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔燃烧焓如下表:
则△H2=___________ 。
②一定温度下,向2L恒容密闭容器中充入2molCO(g)和4molH2(g)制备,初始压强为p0Pa,5min达到平衡时CO(g)的转化率为70%,c(CH3OH)=2c(CH3OCH3),且c(H2)=0.9mol⋅L-1.则0~5min内,v(CO)=___________ mol。L-1.min-1;反应I的平衡常数Kp=___________ (用p0表示);平衡后,保持温度和容器体积不变,向容器中再充入1molCO(g)和2molH2(g),重新达到平衡后,CH3OCH3(g)的物质的量分数___________ (填“增大”、“减小”或“不变”)。
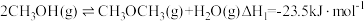 ;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:(1)CO2和H2在某催化剂表面合成CH3OH:
 ,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为
,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为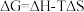 (△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(2)CO催化加氢法合成CH3OH,进而制备CH3OCH3的过程中涉及如下反应:
反应I:
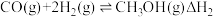
反应II:
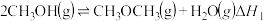
反应III:
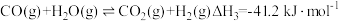
①在298K,101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔燃烧焓如下表:
| 物质 | CO(g) | H2(g) | CH3OH(g) |
| 摩尔燃烧焓(△H)/(kJ·mol-1) | -283.0 | -285.8 | -726.5 |
②一定温度下,向2L恒容密闭容器中充入2molCO(g)和4molH2(g)制备,初始压强为p0Pa,5min达到平衡时CO(g)的转化率为70%,c(CH3OH)=2c(CH3OCH3),且c(H2)=0.9mol⋅L-1.则0~5min内,v(CO)=
您最近一年使用:0次
3 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得: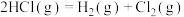 ∆H=
∆H=___________ kJ/mol
②通过盖斯定律可计算。已知在25℃、101kPa时:
I.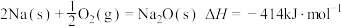
II.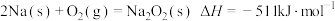
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
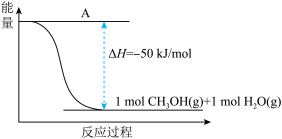
该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的∆H___________ (填“变大”“变小”或“不变”)。
(4)有机物M经过太阳光光照可转化成N,转化过程如下:
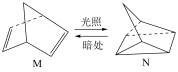
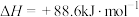
则M、N相比,较稳定的是___________ 。
(1)下列反应中,属于吸热反应的是___________(填字母)。
| A.NaOH与盐酸反应 | B.甲烷的燃烧反应 |
| C.Ba(OH)2∙8H2O与氯化铵反应 | D.锌与盐酸反应 |
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
| 化学键种类 |  |  |  |
| 键能(kJ/mol) | 436 | 247 | 434 |
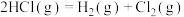 ∆H=
∆H=②通过盖斯定律可计算。已知在25℃、101kPa时:
I.
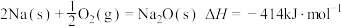
II.
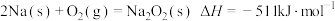
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的∆H
(4)有机物M经过太阳光光照可转化成N,转化过程如下:

则M、N相比,较稳定的是
您最近一年使用:0次
名校
解题方法
4 . 氢能是一种理想的绿色能源,一种太阳能两步法甲烷蒸气重整制氢原理合成示意图如下:
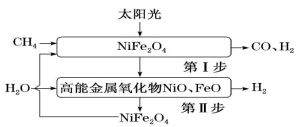
(1)第I步: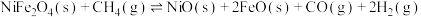
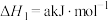 。总反应可表示为:
。总反应可表示为: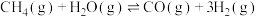
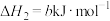 。写出第II步反应的热化学方程式:
。写出第II步反应的热化学方程式:___________ 。
(2)实验测得分步制氢比直接利用 和
和 反应具有更高的反应效率,原因是
反应具有更高的反应效率,原因是________ 。
(3)第I、II步反应的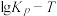 图像如下。
图像如下。
由图像可知a___________ b(填“大于”或“小于”),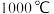 时第I步反应平衡时
时第I步反应平衡时 的平衡分压
的平衡分压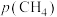
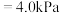 ,则平衡混合气体中
,则平衡混合气体中 的体积分数为
的体积分数为___________ (保留一位小数)。
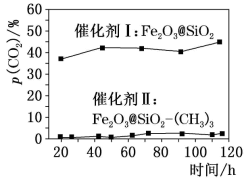
(4)第I步反应产生的合成气(CO和 的混合气体)可用于F—T合成(以合成气为原料在催化剂和适当条件下合成碳氢化合物的工艺过程)。合成碳氢化合物时易发生副反应:
的混合气体)可用于F—T合成(以合成气为原料在催化剂和适当条件下合成碳氢化合物的工艺过程)。合成碳氢化合物时易发生副反应: ,如下图为相同条件下用不同催化剂在不同时间段测得反应体系内
,如下图为相同条件下用不同催化剂在不同时间段测得反应体系内 的分数,据此应选择的催化剂是
的分数,据此应选择的催化剂是___________ (填“I”或“II”),选择的依据是___________ 。

(1)第I步:
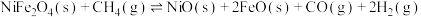
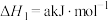 。总反应可表示为:
。总反应可表示为: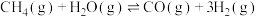
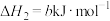 。写出第II步反应的热化学方程式:
。写出第II步反应的热化学方程式:(2)实验测得分步制氢比直接利用
 和
和 反应具有更高的反应效率,原因是
反应具有更高的反应效率,原因是(3)第I、II步反应的
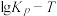 图像如下。
图像如下。
由图像可知a
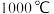 时第I步反应平衡时
时第I步反应平衡时 的平衡分压
的平衡分压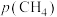
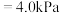 ,则平衡混合气体中
,则平衡混合气体中 的体积分数为
的体积分数为(4)第I步反应产生的合成气(CO和
 的混合气体)可用于F—T合成(以合成气为原料在催化剂和适当条件下合成碳氢化合物的工艺过程)。合成碳氢化合物时易发生副反应:
的混合气体)可用于F—T合成(以合成气为原料在催化剂和适当条件下合成碳氢化合物的工艺过程)。合成碳氢化合物时易发生副反应: ,如下图为相同条件下用不同催化剂在不同时间段测得反应体系内
,如下图为相同条件下用不同催化剂在不同时间段测得反应体系内 的分数,据此应选择的催化剂是
的分数,据此应选择的催化剂是
您最近一年使用:0次
5 . Ⅰ.对温室气体二氧化碳的处理是化学工作者实现“碳中和”重点研究的课题。一种新的循环利用方案是用Bosch反应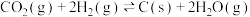

(1)①已知: 和
和 的生成焓为
的生成焓为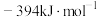 和
和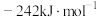 。则
。则
___________  。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)
。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)
②若要此反应自发进行,___________ (填“高温”或“低温”)更有利。
③Bosch反应必须在高温下才能启动,原因是___________ 。
(2)350℃时,向体积为2L的恒容密闭容器中通入8mol 和4mol
和4mol 发生Bosch反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示(其中P为大气压):
发生Bosch反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示(其中P为大气压):
①350℃时Bosch反应的
___________ 。(用含P的表达式表示)( 为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②已知Bosch反应的速率方程: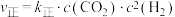 ,
,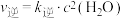 。30min时,
。30min时,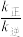
___________ 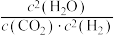 (填“>”、“<”或“=”,下同);升高温度,
(填“>”、“<”或“=”,下同);升高温度, 增大倍数
增大倍数___________  增大倍数。
增大倍数。
Ⅱ. 和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。 和
和 在催化剂表面发生反应:。
在催化剂表面发生反应:。
(3)T℃时,向1L密闭容器中投入1mol 和1mol
和1mol ,5小时后测得反应体系达到平衡状态,此时
,5小时后测得反应体系达到平衡状态,此时 ,计算该温度下
,计算该温度下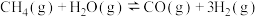 平衡常数
平衡常数
___________ ,该温度下达到平衡时 的平均生成速率为
的平均生成速率为___________  。平衡时
。平衡时 的转化率为
的转化率为___________ 。
(4)T℃时,若再向容器中同时充入2.0mol 、6.0mol
、6.0mol 、4.0mol CO和8.0mol
、4.0mol CO和8.0mol ,则上述平衡向
,则上述平衡向___________ (填“正反应”或“逆反应”)方向移动。
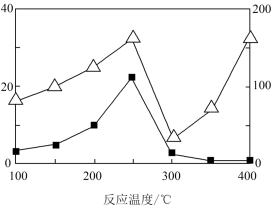
(5)在不同温度下催化剂的催化效率与CO的生成速率如图所示。___________ (△代表CO的生成速率,■代表催化剂的催化效率)
(6)为了提高该反应中 的平衡转化率,可以采取的措施是(写一点即可)
的平衡转化率,可以采取的措施是(写一点即可)___________ 。
(7)以 为原料可以合成多种物质。以KOH水溶液作电解质进行电解,
为原料可以合成多种物质。以KOH水溶液作电解质进行电解, 在铜电极上可转化为甲烷,该电极的电极反应式为
在铜电极上可转化为甲烷,该电极的电极反应式为___________ 。
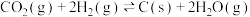

(1)①已知:
 和
和 的生成焓为
的生成焓为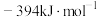 和
和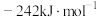 。则
。则
 。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)
。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)②若要此反应自发进行,
③Bosch反应必须在高温下才能启动,原因是
(2)350℃时,向体积为2L的恒容密闭容器中通入8mol
 和4mol
和4mol 发生Bosch反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示(其中P为大气压):
发生Bosch反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示(其中P为大气压):| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 6.00P | 5.60P | 5.30P | 5.15P | 5.06P | 5.00P | 5.00P |

 为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)②已知Bosch反应的速率方程:
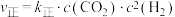 ,
,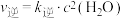 。30min时,
。30min时,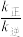
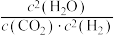 (填“>”、“<”或“=”,下同);升高温度,
(填“>”、“<”或“=”,下同);升高温度, 增大倍数
增大倍数 增大倍数。
增大倍数。Ⅱ.
 和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。 和
和 在催化剂表面发生反应:。
在催化剂表面发生反应:。(3)T℃时,向1L密闭容器中投入1mol
 和1mol
和1mol ,5小时后测得反应体系达到平衡状态,此时
,5小时后测得反应体系达到平衡状态,此时 ,计算该温度下
,计算该温度下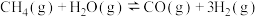 平衡常数
平衡常数
 的平均生成速率为
的平均生成速率为 。平衡时
。平衡时 的转化率为
的转化率为(4)T℃时,若再向容器中同时充入2.0mol
 、6.0mol
、6.0mol 、4.0mol CO和8.0mol
、4.0mol CO和8.0mol ,则上述平衡向
,则上述平衡向(5)在不同温度下催化剂的催化效率与CO的生成速率如图所示。
(6)为了提高该反应中
 的平衡转化率,可以采取的措施是(写一点即可)
的平衡转化率,可以采取的措施是(写一点即可)(7)以
 为原料可以合成多种物质。以KOH水溶液作电解质进行电解,
为原料可以合成多种物质。以KOH水溶液作电解质进行电解, 在铜电极上可转化为甲烷,该电极的电极反应式为
在铜电极上可转化为甲烷,该电极的电极反应式为
您最近一年使用:0次
2023-11-15更新
|
187次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 请回答下列问题:
(1)工业上以 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。
反应分两步:i. 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
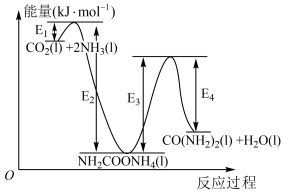
结合反应过程中能量变化示意图,合成尿素总反应的 为
为___________ 。(用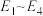 列式表示)
列式表示)
(2)根据表格计算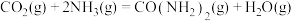

___________ 。
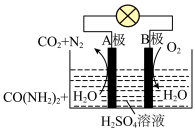
(3)尿素 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为___________ 。
(4)近年研究发现,电催化 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
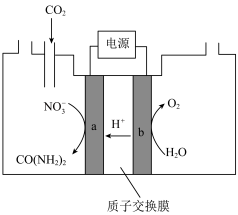
①电极b是电解池的___________ 极。
②尿素分子中,C元素的价态为___________ 。电解过程中生成尿素的电极反应为___________ 。
(5)以石墨为阳极、铁为阴极电解含 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。

①0~1 min时,阴极发生的主要电极反应方程式为___________ 。
②若向废水中加入一定量的NaCl,则电解后的废水中 几乎完全转化为
几乎完全转化为 ,原因是
,原因是___________ 。
(1)工业上以
 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。反应分两步:i.
 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
结合反应过程中能量变化示意图,合成尿素总反应的
 为
为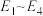 列式表示)
列式表示)(2)根据表格计算
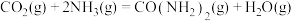

| 化学键 |  |  |  |  |
键能( ) ) | 389 | 728 | 305 | 464 |
(3)尿素
 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
(4)近年研究发现,电催化
 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
①电极b是电解池的
②尿素分子中,C元素的价态为
(5)以石墨为阳极、铁为阴极电解含
 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
①0~1 min时,阴极发生的主要电极反应方程式为
②若向废水中加入一定量的NaCl,则电解后的废水中
 几乎完全转化为
几乎完全转化为 ,原因是
,原因是
您最近一年使用:0次
解题方法
7 . 碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分,写出该反应的热化学方程式___________ 。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=—112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=—234kJ/mol
(2)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol•L-1•min-1。
(3)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示:
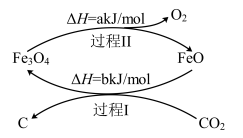
①在转化过程中起催化作用的物质是___________ 。
②写出总反应的化学方程式___________ 。
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应分两步进行:
CO(NH2)2(l)+H2O(l),该反应分两步进行:
①2NH3(g)+CO2(g) NH4COONH2(s)
NH4COONH2(s)
②NH4COONH2(s) =CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白:
①已知该反应可以自发进行,则△H___________ 0(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
=x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为___________ 。

③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体物质的量变为起始时气体物质的量的 时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=_______ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分,写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=—112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=—234kJ/mol
(2)N2O5的分解反应2N2O5(g)
 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(3)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示:

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l),该反应分两步进行:
CO(NH2)2(l)+H2O(l),该反应分两步进行:①2NH3(g)+CO2(g)
 NH4COONH2(s)
NH4COONH2(s)②NH4COONH2(s) =CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白:
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比
 =x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
=x,如图是x与CO2的平衡转化率(α)的关系,B点处,NH3的平衡转化率为
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体物质的量变为起始时气体物质的量的
 时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
时达到平衡,测得此时生成尿素90g,则第①步反应的平衡常数K=
您最近一年使用:0次
名校
8 . “低碳经济”已成为全世界科学家研究的重要课题。其中技术固碳是化学家不断探索的方向,主要应用碳捕集、利用与封存技术。下面是一些利用 为原料制备物质的反应,根据所学知识回答下列问题:
为原料制备物质的反应,根据所学知识回答下列问题:
Ⅰ. 合成尿素的反应为
合成尿素的反应为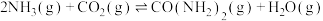
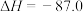 kJ⋅mol-1,如图是上述反应合成尿素的机理及能量变化(单位:kJ/mol),TS表示过渡态。
kJ⋅mol-1,如图是上述反应合成尿素的机理及能量变化(单位:kJ/mol),TS表示过渡态。

(1)若 kJ⋅mol-1,则
kJ⋅mol-1,则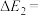
___________ kJ/mol。
(2)分别向等温等容、绝热等容(起始温度相同)的密闭容器中加入0.2 mol的 和0.1 mol的
和0.1 mol的 ,若达平衡时等温等容容器中
,若达平衡时等温等容容器中 百分含量为a%,绝热等容容器中
百分含量为a%,绝热等容容器中 百分含量为b%,则a
百分含量为b%,则a___________ b(填“大于”“小于”或“等于”),理由是___________ 。
Ⅱ.在一定条件下 、
、 主要发生以下反应:
主要发生以下反应:
①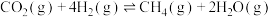
 kJ⋅mol-1
kJ⋅mol-1
②
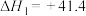 kJ⋅mol-1
kJ⋅mol-1
向恒压密闭容器中充入物质的量之比为1∶4的 和
和 ,发生上述反应,实验测得
,发生上述反应,实验测得 平衡转化率和平衡时的选择性随温度的变化如图所示。(已知:的选择性
平衡转化率和平衡时的选择性随温度的变化如图所示。(已知:的选择性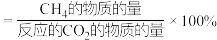 )
)
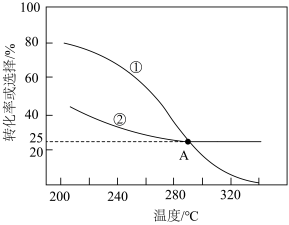
(3)其中表示平衡时 的选择性的曲线是
的选择性的曲线是___________ (填“①”或“②”);A点时 的转化率为
的转化率为___________ (保留小数点后一位)
(4)若在一定温度下,投料比例相同(充入物质的量之比为1∶4的 和
和 ),通入恒容密闭容器中,发生上述反应达到平衡,测得反应前容器内压强为
),通入恒容密闭容器中,发生上述反应达到平衡,测得反应前容器内压强为 ,平衡时
,平衡时 压强为
压强为 ,甲烷压强为
,甲烷压强为 。则甲烷的选择性为
。则甲烷的选择性为___________ (用 、
、 、
、 中相关字母表示,下同),反应②的压强平衡常数
中相关字母表示,下同),反应②的压强平衡常数 的值为
的值为___________ 。
 为原料制备物质的反应,根据所学知识回答下列问题:
为原料制备物质的反应,根据所学知识回答下列问题:Ⅰ.
 合成尿素的反应为
合成尿素的反应为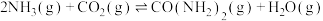
 kJ⋅mol-1,如图是上述反应合成尿素的机理及能量变化(单位:kJ/mol),TS表示过渡态。
kJ⋅mol-1,如图是上述反应合成尿素的机理及能量变化(单位:kJ/mol),TS表示过渡态。
(1)若
 kJ⋅mol-1,则
kJ⋅mol-1,则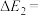
(2)分别向等温等容、绝热等容(起始温度相同)的密闭容器中加入0.2 mol的
 和0.1 mol的
和0.1 mol的 ,若达平衡时等温等容容器中
,若达平衡时等温等容容器中 百分含量为a%,绝热等容容器中
百分含量为a%,绝热等容容器中 百分含量为b%,则a
百分含量为b%,则aⅡ.在一定条件下
 、
、 主要发生以下反应:
主要发生以下反应:①
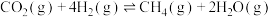
 kJ⋅mol-1
kJ⋅mol-1②

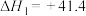 kJ⋅mol-1
kJ⋅mol-1向恒压密闭容器中充入物质的量之比为1∶4的
 和
和 ,发生上述反应,实验测得
,发生上述反应,实验测得 平衡转化率和平衡时的选择性随温度的变化如图所示。(已知:的选择性
平衡转化率和平衡时的选择性随温度的变化如图所示。(已知:的选择性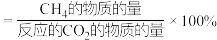 )
)
(3)其中表示平衡时
 的选择性的曲线是
的选择性的曲线是 的转化率为
的转化率为(4)若在一定温度下,投料比例相同(充入物质的量之比为1∶4的
 和
和 ),通入恒容密闭容器中,发生上述反应达到平衡,测得反应前容器内压强为
),通入恒容密闭容器中,发生上述反应达到平衡,测得反应前容器内压强为 ,平衡时
,平衡时 压强为
压强为 ,甲烷压强为
,甲烷压强为 。则甲烷的选择性为
。则甲烷的选择性为 、
、 、
、 中相关字母表示,下同),反应②的压强平衡常数
中相关字母表示,下同),反应②的压强平衡常数 的值为
的值为
您最近一年使用:0次
名校
9 . 近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨。以下是两种制取过程:
一、利用CO2制取甲醇
当原料组成为n(CO2):n(H2)=1:3通入某密闭容器,合成CH3OH的反应体系中主要包含以下反应:
反应①:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=+41.2kJ/mol
(1)已知反应②的v正=k正c(CO2)·c(H2),v逆=k逆c(H2O)·c(CO)(k正、k逆为速率常数,与温度、催化剂有关)。若平衡后升高温度,则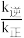
___________ (填“增大”、“不变”或“减小”)。
(2)维持压强为6.4MPa,测得不同温度下,反应经过相同时间时CO2的转化率、甲醇的选择性如图所示[CH3OH的选择性=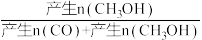 ×100%]。
×100%]。
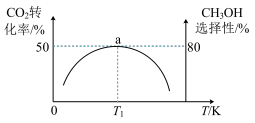
①ΔH1___________ 0(填“<”或“>”),判断的依据是___________ 。
②T1K时,若反应从开始到达到a点所用时间为5min,则v(CH3OH)=___________ MPa·min-1,反应②的Kp=___________ (Kp指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=p总×A的物质的量分数,计算结果保留2位有效数字)。
二、利用烯烃催化制取甲醇
制取过程中发生如下反应:
反应I:C3H6(g)+3H2O(g)⇌3CH3OH(g) ΔH2
反应Ⅱ:C2H4(g)+2H2O(g)⇌2CH3OH(g) ΔH3
反应Ⅲ:3C2H4(g)⇌2C3H6(g) ΔH4
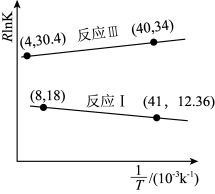
(3)反应I、Ⅲ的vantHoff实验数据如图所示(vantHoff经验公式RInK=- +C,
+C,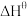 为标准焓变,K为平衡常数,R和C为常数)。根据图判断:ΔH3=
为标准焓变,K为平衡常数,R和C为常数)。根据图判断:ΔH3=___________ (用含ΔH2和ΔH4的计算式表示),反应Ⅲ的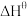
___________ kJ·mol-1。
一、利用CO2制取甲醇
当原料组成为n(CO2):n(H2)=1:3通入某密闭容器,合成CH3OH的反应体系中主要包含以下反应:
反应①:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=+41.2kJ/mol
(1)已知反应②的v正=k正c(CO2)·c(H2),v逆=k逆c(H2O)·c(CO)(k正、k逆为速率常数,与温度、催化剂有关)。若平衡后升高温度,则
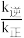
(2)维持压强为6.4MPa,测得不同温度下,反应经过相同时间时CO2的转化率、甲醇的选择性如图所示[CH3OH的选择性=
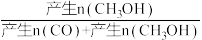 ×100%]。
×100%]。
①ΔH1
②T1K时,若反应从开始到达到a点所用时间为5min,则v(CH3OH)=
二、利用烯烃催化制取甲醇
制取过程中发生如下反应:
反应I:C3H6(g)+3H2O(g)⇌3CH3OH(g) ΔH2
反应Ⅱ:C2H4(g)+2H2O(g)⇌2CH3OH(g) ΔH3
反应Ⅲ:3C2H4(g)⇌2C3H6(g) ΔH4
(3)反应I、Ⅲ的vantHoff实验数据如图所示(vantHoff经验公式RInK=-
 +C,
+C,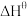 为标准焓变,K为平衡常数,R和C为常数)。根据图判断:ΔH3=
为标准焓变,K为平衡常数,R和C为常数)。根据图判断:ΔH3=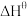

您最近一年使用:0次
10 . 将玉米秸秆进行热化学裂解可制备出以CO、CO2、H2、N2为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
(1)已知:几种常见物质的燃烧热如表所示。
由此可估算反应CO(g)+2H2(g) CH3OH(g)的焓变△H=
CH3OH(g)的焓变△H=______ kJ•mol-1。
(2)某科研小组探究在其他条件不变的情况下,改变起始物CO与H2的物质的量对合成CH3OH的平衡体积分数的影响如图1所示。图像中T1和T2的关系是T1______ (填“>”、“<”、“=”或“无法确定”)T2。T1时,在a、b、c三点所处的平衡状态中,反应物H2的转化率最大的是______ (填字母)点。
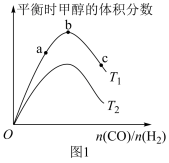
(3)控制起始时容器中只有amol•L-1和bmol•L-1H2,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图2所示。
①该反应在一定条件下的密闭容器中达到平衡,要提高CO的转化率,可以采取的措施有_____ (任写一点)。
②若恒温恒容条件下,起始时a=b=2,则下列叙述不能说明反应达到化学平衡状态的是_____ (填标号)。
A.混合气体的密度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.CO、H2的物质的量浓度之比不再随时间的变化而变化
D.若将容器改为绝热恒容容器,平衡常数K不随时间变化而变化
③压强为p1kPa,温度为T1和T2时对应的平衡常数分别为K1、K2,则K1______ (填“>”、“<”或“=”)K2,若恒温(T1)恒容条件下,起始时a:b=1:2,测得平衡时混合气体的压强为p1kPa,则 时该反应的压强平衡常数Kp=
时该反应的压强平衡常数Kp=_____ kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)。
(1)已知:几种常见物质的燃烧热如表所示。
| 燃料 | CO(g) | CH3OH(g) | H2(g) |
| 燃烧热/(kJ•mol-1) | -283 | -766.51 | -285.8 |
 CH3OH(g)的焓变△H=
CH3OH(g)的焓变△H=(2)某科研小组探究在其他条件不变的情况下,改变起始物CO与H2的物质的量对合成CH3OH的平衡体积分数的影响如图1所示。图像中T1和T2的关系是T1

(3)控制起始时容器中只有amol•L-1和bmol•L-1H2,测得平衡时混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图2所示。

①该反应在一定条件下的密闭容器中达到平衡,要提高CO的转化率,可以采取的措施有
②若恒温恒容条件下,起始时a=b=2,则下列叙述不能说明反应达到化学平衡状态的是
A.混合气体的密度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.CO、H2的物质的量浓度之比不再随时间的变化而变化
D.若将容器改为绝热恒容容器,平衡常数K不随时间变化而变化
③压强为p1kPa,温度为T1和T2时对应的平衡常数分别为K1、K2,则K1
 时该反应的压强平衡常数Kp=
时该反应的压强平衡常数Kp=
您最近一年使用:0次
2023-02-03更新
|
250次组卷
|
4卷引用:福建省泉州市部分校联考2022-2023学年高三下学期1月月考化学试题



