解题方法
1 . 氢气在实验室和工业上有着广泛的用途。请回答:
(1)氢气可以与煤在催化剂作用下制备乙炔,已知部分反应如下:
Ⅰ.

Ⅱ.

Ⅲ.
Ⅳ.

通过计算说明反应Ⅳ自发进行的条件_______ 。
(2)利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应:
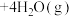 ,平衡时水蒸气的物质的量百分数为50.0%。请回答:
,平衡时水蒸气的物质的量百分数为50.0%。请回答:
①反应的平衡常数表达式为_______ 。
②达到平衡时, 的转化率为
的转化率为_______ 。
(3)氢气可合成氨气,氨气与二氧化碳可以合成尿素,反应为:
 ,分为两步:
,分为两步:
已知投料的组成为 、
、 和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵(
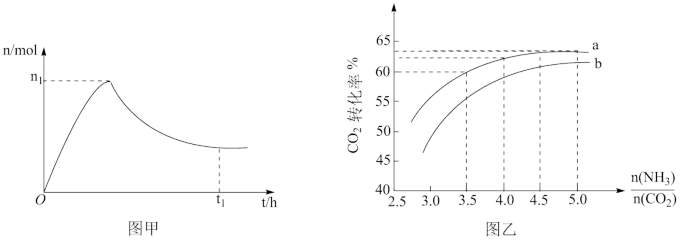
和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵( )物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(
)物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(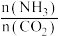 )与水碳比(
)与水碳比(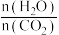 )投料时
)投料时 平衡转化率图象(图乙,a、b代表水碳比):
平衡转化率图象(图乙,a、b代表水碳比):
回答下列问题:
①已知反应I又可以分成两步:_______、 ,请写出第一步的化学方程式
,请写出第一步的化学方程式_______ 。
②下列叙述正确的是_______ 。
A.反应Ⅰ的活化能大于反应Ⅱ,
B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移
C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右
D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,请在图甲中画出保持其他条件不变,加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线_______ 。
(1)氢气可以与煤在催化剂作用下制备乙炔,已知部分反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.

通过计算说明反应Ⅳ自发进行的条件
(2)利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以
 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应:
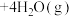 ,平衡时水蒸气的物质的量百分数为50.0%。请回答:
,平衡时水蒸气的物质的量百分数为50.0%。请回答:①反应的平衡常数表达式为
②达到平衡时,
 的转化率为
的转化率为(3)氢气可合成氨气,氨气与二氧化碳可以合成尿素,反应为:

 ,分为两步:
,分为两步:反应步骤 | 反应方程式 |
|
| Ⅰ | 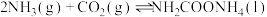  | 快速放热 |
| Ⅱ |  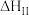 | 慢速吸热 |
已知投料的组成为
 、
、 和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵(
和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵( )物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(
)物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(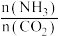 )与水碳比(
)与水碳比(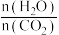 )投料时
)投料时 平衡转化率图象(图乙,a、b代表水碳比):
平衡转化率图象(图乙,a、b代表水碳比):
回答下列问题:
①已知反应I又可以分成两步:_______、
 ,请写出第一步的化学方程式
,请写出第一步的化学方程式②下列叙述正确的是
A.反应Ⅰ的活化能大于反应Ⅱ,

B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移
C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右
D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,请在图甲中画出保持其他条件不变,加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线
您最近一年使用:0次
2 . 按要求完成下列问题。
(1)二氧化硫在工业上和生活中有广泛的用途。工业用SO2和O2反应合成SO3反应的反应热(ΔH)、活化能(Ea正)为:SO2(g)+ O2(g)⇌SO3(g) ΔH=-98.0kJ·mol-1 Ea正=125.5kJ·mol-1
O2(g)⇌SO3(g) ΔH=-98.0kJ·mol-1 Ea正=125.5kJ·mol-1
①三氧化硫的分解反应SO3(g)⇌SO2(g)+ O2(g)的活化能Ea正=
O2(g)的活化能Ea正=___________ 。
②下列关于工业用SO2和O2反应合成SO3反应的理解正确的是___________ 。
A.增大氧气浓度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
B.该反应的实际工业生产条件是高温、高压、合适的催化剂
C.当温度、压强一定时,在原料气(SO2和O2的比例不变)中添加少量惰性气体,会使平衡转化率减小
D.反应过程中,可将SO3液化,并不断将液态SO3移去,有利于提高正反应速率
(2)CO和H2在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g)获得甲醇。向2L的密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
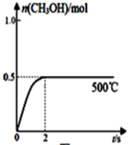
①500℃的此反应的平衡常数K=___________ 。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是___________ (用化学方程式表示)。
③在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)随时间t变化的总趋势图_________ 。
(1)二氧化硫在工业上和生活中有广泛的用途。工业用SO2和O2反应合成SO3反应的反应热(ΔH)、活化能(Ea正)为:SO2(g)+
 O2(g)⇌SO3(g) ΔH=-98.0kJ·mol-1 Ea正=125.5kJ·mol-1
O2(g)⇌SO3(g) ΔH=-98.0kJ·mol-1 Ea正=125.5kJ·mol-1①三氧化硫的分解反应SO3(g)⇌SO2(g)+
 O2(g)的活化能Ea正=
O2(g)的活化能Ea正=②下列关于工业用SO2和O2反应合成SO3反应的理解正确的是
A.增大氧气浓度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
B.该反应的实际工业生产条件是高温、高压、合适的催化剂
C.当温度、压强一定时,在原料气(SO2和O2的比例不变)中添加少量惰性气体,会使平衡转化率减小
D.反应过程中,可将SO3液化,并不断将液态SO3移去,有利于提高正反应速率
(2)CO和H2在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g)获得甲醇。向2L的密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。

①500℃的此反应的平衡常数K=
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是
③在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)随时间t变化的总趋势图
您最近一年使用:0次



