名校
解题方法
1 . 如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中E表示分子平均能量,Ec是活化分子具有的最低能量。下列说法不正确的是
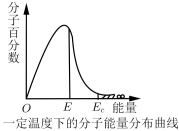

| A.图中Ec与E之差表示活化能 |
| B.升高温度,图中阴影部分面积会增大 |
| C.使用合适的催化剂,E不变,Ec变小 |
| D.能量大于Ec的分子间发生的碰撞一定是有效碰撞 |
您最近一年使用:0次
2020-03-05更新
|
258次组卷
|
3卷引用:湖北省荆州市2020届高三上学期质量检测(一) 化学试题
名校
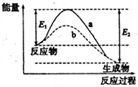
2 . 右图表示某可逆反应:N2(g)+3H2(g) 2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
 2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
| A.反应物的总键能小于生成物的总键能 |
| B.如果对上述反应加压,平衡正向移动,△H减小 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.a与b相比,a的反应速率更快 |
您最近一年使用:0次
2017-12-04更新
|
226次组卷
|
2卷引用:湖北省荆州中学2019-2020学年高二上学期第一次月考化学试题
3 . 氨的用途十分广泛,是制造硝酸和氮肥的重要原料。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于___________ kJ
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
(3)已知合成氨反应的速率方程为:ν=kcα(N2)cβ(H2)c-1(NH3),在合成氨过程中,需要不断分离出氨,可能的原因为___________ 。
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①为进一步提高NH3的平衡转化率,下列措施能达到目的的是___________ (填标号)。
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g) NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/mol
b.NH2COONH4(1) CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是___________ (填“第一步”或“第二步”)。
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
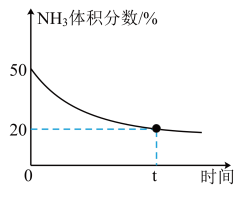
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=___________ MPa-2(已知:分压=总压×体积分数)。
(1)工业合成氨中,合成塔中每产生2 molNH3,放出92.2kJ热量。

1 mol N-H键断裂吸收的能量约等于
(2)一定条件下,在恒温恒容的密闭容器中充入等物质的量N2和H2发生反应生成NH3,下列状态能说明反应达到平衡的是___________(填标号)。
| A.容器内压强不变 | B.N2的体积分数不变 |
| C.气体的密度不再改变 | D.V正(N2)=3V逆(H2) |
(4)以氨为原料生产尿素的方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。①为进一步提高NH3的平衡转化率,下列措施能达到目的的是
A.增大CO2的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.2NH3(g)+CO2(g)
 NH2COONH4(1) ΔH= ‒117 kJ/mol
NH2COONH4(1) ΔH= ‒117 kJ/molb.NH2COONH4(1)
 CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是
CO(NH2)2(1)+H2O(g) ΔH= +15 kJ/mol,第一步反应速率快,可判断活化能较大的是③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的CO2和NH3发生反应:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
CO(NH2)2(l)+H2O(g),反应过程中混合气体中NH3的体积分数如下图所示。
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数Kp=
您最近一年使用:0次
解题方法
4 . 乙醇是一种重要的工业原料,广泛应用于能源、化工、食品等领域。
Ⅰ.工业上乙烯水化制乙醇过程中能量变化如图所示:
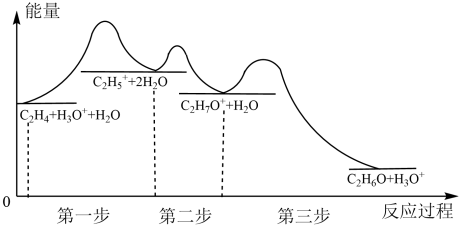
(1)图中所示活化能最大的步骤是第_______ 步。
(2)写出该反应过程中速率最快的基元反应:_______ 。
Ⅱ.研究显示乙酸甲酯催化加氢也可以制取乙醇,主要反应如下:
①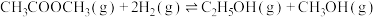
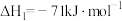
②

(3)已知反应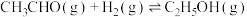 的
的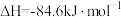 ,则
,则
_______ 。
(4)在体积密闭容器中进行上述反应时发现, 流速过大时乙酸甲酯的转化率下降,其原因可能是
流速过大时乙酸甲酯的转化率下降,其原因可能是_______ 。
Ⅲ.乙醇的一种重要用途是与乙酸反应合成乙酸乙酯。已知纯物质和相关恒沸混合物的常压沸点如下表:
(5)实际生产中,一般控制乙酸过量。若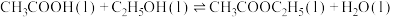
 ,则控制乙酸过量的作用有
,则控制乙酸过量的作用有_______ 。
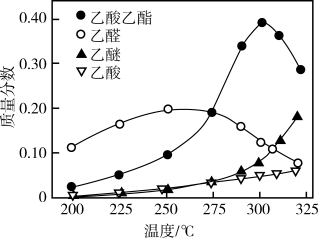
(6)一种新的乙醇催化合成乙酸乙酯的方法如下: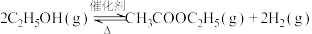 。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
Ⅰ.工业上乙烯水化制乙醇过程中能量变化如图所示:

(1)图中所示活化能最大的步骤是第
(2)写出该反应过程中速率最快的基元反应:
Ⅱ.研究显示乙酸甲酯催化加氢也可以制取乙醇,主要反应如下:
①
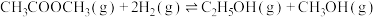
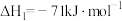
②


(3)已知反应
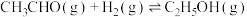 的
的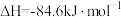 ,则
,则
(4)在体积密闭容器中进行上述反应时发现,
 流速过大时乙酸甲酯的转化率下降,其原因可能是
流速过大时乙酸甲酯的转化率下降,其原因可能是Ⅲ.乙醇的一种重要用途是与乙酸反应合成乙酸乙酯。已知纯物质和相关恒沸混合物的常压沸点如下表:
| 纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
| 乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
| 乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
| 乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08)+水(0.09) | 70.2 |
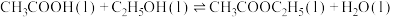
 ,则控制乙酸过量的作用有
,则控制乙酸过量的作用有(6)一种新的乙醇催化合成乙酸乙酯的方法如下:
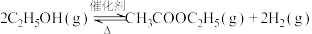 。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
。在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是_______。
| A.该反应的最宜温度应为325℃ |
| B.适当减小体系压强,有利于提高乙醇平衡转化率 |
| C.在催化剂作用下,乙醚是反应历程中的中间产物 |
| D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键 |
您最近一年使用:0次
2022-11-03更新
|
170次组卷
|
2卷引用:湖北省鄂东南联盟2022-2023学年高三上学期期中联考化学试题
5 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)

b)

c)

d)

e)

(1)已知相关物质的燃烧热(25℃、101 kPa):
则△H1=___________ 。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a)


b)


c)


d)


e)


(1)已知相关物质的燃烧热(25℃、101 kPa):
| 物质 | CH4(g) | CO(g) | H2(g) |
燃烧热(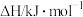 ) ) |  |  |  |
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.移去部分C(s),反应c、d、e的平衡均向右移动 |
| B.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
2021·浙江台州·一模
解题方法
6 . 氢气在实验室和工业上有着广泛的用途。请回答:
(1)氢气可以与煤在催化剂作用下制备乙炔,已知部分反应如下:
Ⅰ.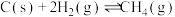

Ⅱ.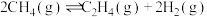

Ⅲ.
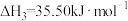
Ⅳ.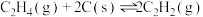

通过计算说明反应Ⅳ自发进行的条件_______ 。
(2)利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应:
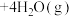 ,平衡时水蒸气的物质的量百分数为50.0%。请回答:
,平衡时水蒸气的物质的量百分数为50.0%。请回答:
①反应的平衡常数表达式为_______ 。
②达到平衡时, 的转化率为
的转化率为_______ 。
(3)氢气可合成氨气,氨气与二氧化碳可以合成尿素,反应为:
 ,分为两步:
,分为两步:
已知投料的组成为 、
、 和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵(
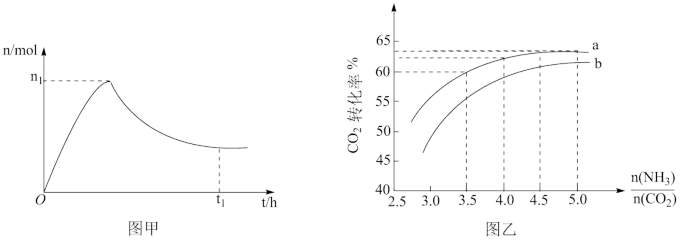
和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵( )物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(
)物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(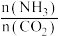 )与水碳比(
)与水碳比(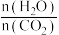 )投料时
)投料时 平衡转化率图象(图乙,a、b代表水碳比):
平衡转化率图象(图乙,a、b代表水碳比):
回答下列问题:
①已知反应I又可以分成两步:_______、 ,请写出第一步的化学方程式
,请写出第一步的化学方程式_______ 。
②下列叙述正确的是_______ 。
A.反应Ⅰ的活化能大于反应Ⅱ,
B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移
C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右
D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,请在图甲中画出保持其他条件不变,加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线_______ 。
(1)氢气可以与煤在催化剂作用下制备乙炔,已知部分反应如下:
Ⅰ.
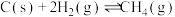

Ⅱ.
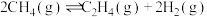

Ⅲ.

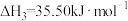
Ⅳ.
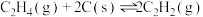

通过计算说明反应Ⅳ自发进行的条件
(2)利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以
 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应:
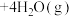 ,平衡时水蒸气的物质的量百分数为50.0%。请回答:
,平衡时水蒸气的物质的量百分数为50.0%。请回答:①反应的平衡常数表达式为
②达到平衡时,
 的转化率为
的转化率为(3)氢气可合成氨气,氨气与二氧化碳可以合成尿素,反应为:

 ,分为两步:
,分为两步:反应步骤 | 反应方程式 |
|
| Ⅰ | 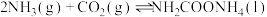  | 快速放热 |
| Ⅱ |  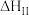 | 慢速吸热 |
已知投料的组成为
 、
、 和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵(
和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵( )物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(
)物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(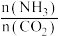 )与水碳比(
)与水碳比(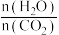 )投料时
)投料时 平衡转化率图象(图乙,a、b代表水碳比):
平衡转化率图象(图乙,a、b代表水碳比):
回答下列问题:
①已知反应I又可以分成两步:_______、
 ,请写出第一步的化学方程式
,请写出第一步的化学方程式②下列叙述正确的是
A.反应Ⅰ的活化能大于反应Ⅱ,

B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移
C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右
D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,请在图甲中画出保持其他条件不变,加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线
您最近一年使用:0次
名校
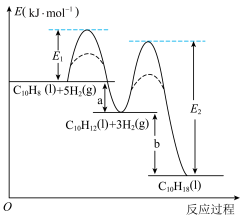
7 . 萘、四氢萘、十氢萘用途广泛,其转化关系为: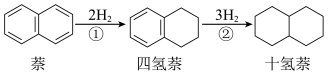 ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:
 ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是:
A.萘分子(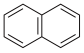 )的一氯代物有2种 )的一氯代物有2种 |
| B.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程 |
| C.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定 |
| D.物质的稳定性:十氢萘>四氢萘>萘 |
您最近一年使用:0次
2019-11-13更新
|
275次组卷
|
3卷引用:湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校2019-2020学年高二11月联考化学试题
8 . 3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点 181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯 相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
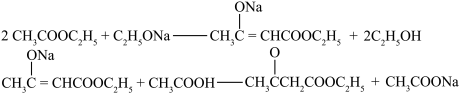
【反应原理】
【实验装置】
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是_____________ 。
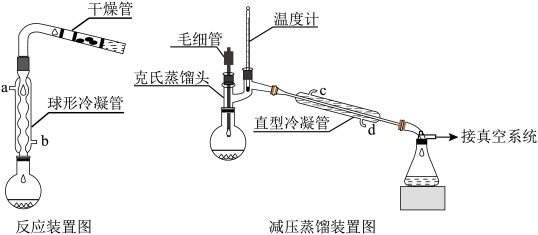
(2)反应装置中加干燥管是为了__________ 。两个装置中冷凝管的作用__________ (填“相同”或“不相同”),冷却水进水口分别为__________ 和_____________ (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是__________ ,稀醋酸不能加多了,原因是___________ 。用分液漏斗分离出酯层的操作叫____________ 。碳酸钠溶液洗涤的目的是_________________ 。加碳酸钾的目的是______________ 。
(4)采用减压蒸馏的原因是_______________ 。
(5)本实验所得到的3-丁酮酸乙酯产率是_____________ (填正确答案标号)。
【反应原理】

【实验装置】

【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是
(2)反应装置中加干燥管是为了
(3)产物后处理中,滴加稀醋酸的目的是
(4)采用减压蒸馏的原因是
(5)本实验所得到的3-丁酮酸乙酯产率是
| A.10% | B.22% | C.19% | D.40% |
您最近一年使用:0次
2016-12-09更新
|
524次组卷
|
2卷引用:2015届湖北省襄阳市普通高中高三1月调研理综化学试卷



