名校
解题方法
1 . 2020年第七十五届联合国大会上,中国向世界郑重承诺在2030年前实现碳达峰,在2060年前实现碳中和。大力发展绿色能源、清洁能源是实现碳中和的最有效方法。
(1)原电池反应能够提供电能而不产生CO2气体,下图是某原电池装置图。______ 极,发生______ (填“氧化”或“还原”)反应。
②Cu棒,上发生的电极反应是______ 。
③溶液中H+向______ (填“Zn”或“Cu”)电极定向移动。
(2)将上述装置中电解质稀H2SO4换为足量AgNO3溶液,灯泡也变亮,电流表指针偏转,无色溶液颜色没有变化。
①原电池的负极是______ (填“Zn”或“Cu”),正极的电极反应是______ 。
②若更换电解质时称量两个电极,质量恰好相等,放电一段时间后再称量两个电极,发现质量相差2.81g,则导线上通过的n(e-)=______ mol。
(3)碱性锌锰电池是日常生活中常用电池,原电池反应是:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH。
该原电池电解质是KOH溶液,写出正极的电极反应______ 。
(1)原电池反应能够提供电能而不产生CO2气体,下图是某原电池装置图。

②Cu棒,上发生的电极反应是
③溶液中H+向
(2)将上述装置中电解质稀H2SO4换为足量AgNO3溶液,灯泡也变亮,电流表指针偏转,无色溶液颜色没有变化。
①原电池的负极是
②若更换电解质时称量两个电极,质量恰好相等,放电一段时间后再称量两个电极,发现质量相差2.81g,则导线上通过的n(e-)=
(3)碱性锌锰电池是日常生活中常用电池,原电池反应是:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH。
该原电池电解质是KOH溶液,写出正极的电极反应
您最近一年使用:0次
2024-01-11更新
|
505次组卷
|
2卷引用:陕西省渭南市杜桥中学2023-2024学年高二上学期期中考试化学试卷
解题方法
2 . 电化学原理广泛应用于日常生活、生产和科学技术等方面,以满足不同的需要。根据如图所示实验装置,分别回答下列问题:
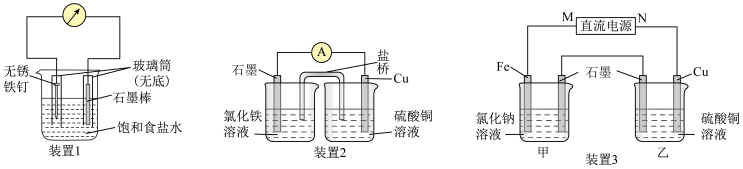
(1)装置1中无锈铁钉电极的电极反应式为_______ 。
(2)装置2中的石墨电极上发生_______ 反应,该装置发生的总反应的离子方程式为_______ 。
(3)装置3中甲烧杯盛放 的
的 溶液,乙烧杯盛放
溶液,乙烧杯盛放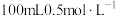 的
的 的溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨极附近首先变红。
的溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨极附近首先变红。
①电源的M端为_______ ,铁电极的质量会_______ (填“增加”、“减小”或“不变”)。
②乙烧杯中电解反应的离子方程式为_______ 。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重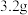 ,则甲烧杯中产生的气体在标准状况下的体积为
,则甲烧杯中产生的气体在标准状况下的体积为_______ 。
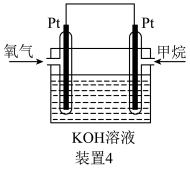
(4)装置4为甲烷燃料电池的构造示意图。正极的电极反应式为_______ 。

(1)装置1中无锈铁钉电极的电极反应式为
(2)装置2中的石墨电极上发生
(3)装置3中甲烧杯盛放
 的
的 溶液,乙烧杯盛放
溶液,乙烧杯盛放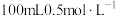 的
的 的溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨极附近首先变红。
的溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨极附近首先变红。①电源的M端为
②乙烧杯中电解反应的离子方程式为
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重
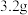 ,则甲烧杯中产生的气体在标准状况下的体积为
,则甲烧杯中产生的气体在标准状况下的体积为(4)装置4为甲烷燃料电池的构造示意图。正极的电极反应式为

您最近一年使用:0次
3 . 回答下列问题:
(1)①反应 过程中的能量变化如图所示,该反应
过程中的能量变化如图所示,该反应
_______  (用含
(用含 、
、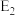 式子表示)。
式子表示)。

②在容积固定的密闭绝热容器中发生上述可逆反应,能证明该可逆反应达到平衡状态的依据是_______
A.混合气体的密度保持不变
B.混合气体的平均摩尔质量保持不变
C.容器内的温度保持不变
D.达到平衡时
E.达到平衡状态时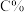 保持不变
保持不变
F.混合气体的总压强不变
(2)符合某些特征的化学反应理论上都可以设计成原电池。下列化学反应_______(填字母)不能设计成原电池。
(3)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 和
和 ,电解
,电解 溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。
溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。

请回答以下问题:
①观察到C极和D极不同的现象是_______
②C极可以选用的材料是_______ (填标号)。
A.铁棒 B.铂片 C.铜棒 D.石墨棒
③A极发生的电极反应为_______
④装置甲、乙中的电解质溶液足量,当电路中通过 电子时,理论上得到的气体c在标准状况下的体积为
电子时,理论上得到的气体c在标准状况下的体积为_______ ;此时气体a、b的总物质的量与气体c、d的总物质的量之比为_______ 。
(1)①反应
 过程中的能量变化如图所示,该反应
过程中的能量变化如图所示,该反应
 (用含
(用含 、
、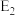 式子表示)。
式子表示)。
②在容积固定的密闭绝热容器中发生上述可逆反应,能证明该可逆反应达到平衡状态的依据是
A.混合气体的密度保持不变
B.混合气体的平均摩尔质量保持不变
C.容器内的温度保持不变
D.达到平衡时

E.达到平衡状态时
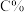 保持不变
保持不变F.混合气体的总压强不变
(2)符合某些特征的化学反应理论上都可以设计成原电池。下列化学反应_______(填字母)不能设计成原电池。
A.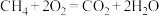 | B. |
C. | D. |
 和
和 ,电解
,电解 溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。
溶液。某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图所示。
请回答以下问题:
①观察到C极和D极不同的现象是
②C极可以选用的材料是
A.铁棒 B.铂片 C.铜棒 D.石墨棒
③A极发生的电极反应为
④装置甲、乙中的电解质溶液足量,当电路中通过
 电子时,理论上得到的气体c在标准状况下的体积为
电子时,理论上得到的气体c在标准状况下的体积为
您最近一年使用:0次
解题方法
4 .  溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用
溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用 溶液进行以下实验探究:
溶液进行以下实验探究:
(1)以 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是___________ (填字母)。
a.溶液中 向阳极移动 b.粗铜接电源正极,发生还原反应
向阳极移动 b.粗铜接电源正极,发生还原反应
c.电解后 溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
(2)图1是根据反应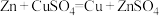 ,设计成的锌铜原电池。Cu极的电极反应式是
,设计成的锌铜原电池。Cu极的电极反应式是___________ ,盐桥中是含有琼胶的KCl饱和溶液,电池工作时 向
向___________ (填“甲”或“乙”)移动。

(3)图2中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜:
①b处通入的是___________ (填“ ”或“
”或“ ”),a处的电极反应式为
”),a处的电极反应式为___________ 。
②当铜电极的质量减轻3.2g,则消耗的 在标准状况下的体积为
在标准状况下的体积为___________ 。
 溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用
溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用 溶液进行以下实验探究:
溶液进行以下实验探究:(1)以
 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是a.溶液中
 向阳极移动 b.粗铜接电源正极,发生还原反应
向阳极移动 b.粗铜接电源正极,发生还原反应c.电解后
 溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属(2)图1是根据反应
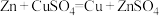 ,设计成的锌铜原电池。Cu极的电极反应式是
,设计成的锌铜原电池。Cu极的电极反应式是 向
向
(3)图2中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜:
①b处通入的是
 ”或“
”或“ ”),a处的电极反应式为
”),a处的电极反应式为②当铜电极的质量减轻3.2g,则消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
解题方法
5 . 某同学设计了如图所示装置,可探究氯碱工业原理和粗铜的精炼原理。

根据要求回答相关问题:
(1)甲装置中通入氧气的电极为_______ ,负极的电极反应式为_______ 。
(2)乙装置中Fe电极为_______ (填“阳极”或“阴极”),电极反应式为_______ 。
(3)乙中的X把电解槽隔成了阴极室和阳极室,X为_______ (填“阴”或“阳”)离子交换膜,它只允许溶液中的_______ 通过(填写下列微粒的编号),而两边的水不能自由流通。
①H2, ②Cl2 ,③H+, ④Cl- ,⑤Na+,⑥OH-。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后, 溶液的浓度
溶液的浓度_______ (“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为_______ g。

根据要求回答相关问题:
(1)甲装置中通入氧气的电极为
(2)乙装置中Fe电极为
(3)乙中的X把电解槽隔成了阴极室和阳极室,X为
①H2, ②Cl2 ,③H+, ④Cl- ,⑤Na+,⑥OH-。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间后,
 溶液的浓度
溶液的浓度(5)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为
您最近一年使用:0次
名校
6 . 生活中,形式多样化的电池,满足不同的市场需求。图中是几种不同类型的原电池装置。
(1)某实验小组设计了如图甲所示装置:a为铝棒,b为镁棒。
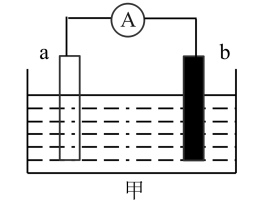
①若容器中盛有 溶液,a极为
溶液,a极为_______ (填“正极”或“负极”);b极附近观察到的现象是_______ 。
②若容器中盛有浓硫酸,b极的电极反应式是_______ ,导线中电子的流动方向是_______ (填“a→b”或“b→a”)。
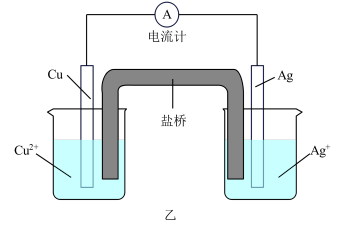
(2)铜-银原电池装置如图乙所示,下列有关叙述正确的是_______(填标号)。
(3)乙烯是水果的催熟剂,又可用作燃料,由 和
和 组成的燃料电池的结构如图丙所示。
组成的燃料电池的结构如图丙所示。
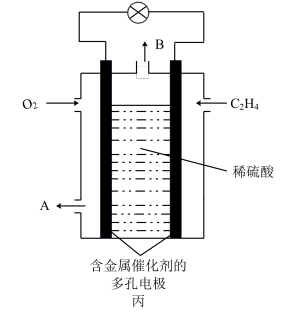
①乙烯燃料电池的正极反应式是_______ 。
②当消耗2.8g乙烯时,生成物质B的体积为_______ L(标准状况下)。
(1)某实验小组设计了如图甲所示装置:a为铝棒,b为镁棒。

①若容器中盛有
 溶液,a极为
溶液,a极为②若容器中盛有浓硫酸,b极的电极反应式是
(2)铜-银原电池装置如图乙所示,下列有关叙述正确的是_______(填标号)。

| A.银电极上发生还原反应 |
| B.电池工作一段时间后,铜极的质量增加 |
| C.取出盐桥后,电流计依旧发生偏转 |
| D.电池工作时,每转移0.1mol电子,两电极的质量差会增加14g |
 和
和 组成的燃料电池的结构如图丙所示。
组成的燃料电池的结构如图丙所示。
①乙烯燃料电池的正极反应式是
②当消耗2.8g乙烯时,生成物质B的体积为
您最近一年使用:0次
2022-03-08更新
|
379次组卷
|
2卷引用:陕西省渭南市临渭区2022-2023学年高二上学期期末考试化学试题
名校
7 . 化学能与电能的相互转化在生产、生活中应用广泛。
(1)高铁电池因其具有众多的优点而成为电动汽车首选的动力电池,其工作原理为:3Zn+2K2FeO4+8H2O 3Zn (OH)2+4KOH+2Fe (OH)3。 则放电时正极的电极反应式为
3Zn (OH)2+4KOH+2Fe (OH)3。 则放电时正极的电极反应式为___________ ,充电时阴极附近溶液的pH___________ (填“增大”、“减小”、“不变”)。
(2)某公司开发出一种以Pt作电极的高效甲醇燃料电池,以该电池电解CuSO4溶液的装置如下图所示:

①工作时负极的电极反应式为___________ 。
②若乙池中Fe电极质量增加12. 8g,在相同时间内,甲池中理论上消耗O2___________ L( 标准状况下)。
③通电一段时间后,向所得溶液中加入0. 3molCu(OH)2后,恰好恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为___________ 。
(3)研究电化学腐蚀及防护的装置如图所示。

若电极d为石墨,写出此电极的反应式___________ ;若电极d为锌块,则铁片不易被腐蚀,该保护法的名称为___________ 。
(1)高铁电池因其具有众多的优点而成为电动汽车首选的动力电池,其工作原理为:3Zn+2K2FeO4+8H2O
 3Zn (OH)2+4KOH+2Fe (OH)3。 则放电时正极的电极反应式为
3Zn (OH)2+4KOH+2Fe (OH)3。 则放电时正极的电极反应式为(2)某公司开发出一种以Pt作电极的高效甲醇燃料电池,以该电池电解CuSO4溶液的装置如下图所示:

①工作时负极的电极反应式为
②若乙池中Fe电极质量增加12. 8g,在相同时间内,甲池中理论上消耗O2
③通电一段时间后,向所得溶液中加入0. 3molCu(OH)2后,恰好恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为
(3)研究电化学腐蚀及防护的装置如图所示。

若电极d为石墨,写出此电极的反应式
您最近一年使用:0次
2022-01-22更新
|
344次组卷
|
4卷引用:陕西省渭南市澄城县2021-2022学年高一下学期期末教学质量检测化学(A卷)试题
陕西省渭南市澄城县2021-2022学年高一下学期期末教学质量检测化学(A卷)试题山东省菏泽市2021-2022学年高二上学期期末教学质量检测化学试题山东省菏泽第一中学2022-2023学年高二上学期期末考试模拟检测化学试题(已下线)题型03 新型化学电池-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
8 . 如图所示的装置,X、Y都是惰性电极。将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色。丙池中盛有100 mL 3.00 mol。L-1的CuSO4溶液。试回答下列问题:
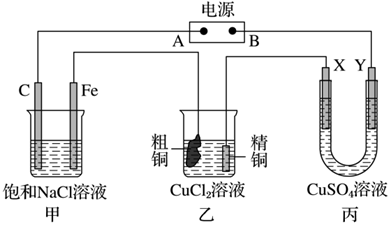
(1)在电源中,B电极为___________ 极(填电极名称,下同),A电极为___________ 极;乙装置中粗铜为___________ 极,精铜为___________ 极。
(2)在甲装置中,石墨(C)电极上发生___________ 反应(填“氧化”或“还原”);甲装置中总的化学方程式是___________ 。
(3)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为___________ L。
(4)在丙装置中,X电极上发生的电极反应式是___________ 。
(5)在此过程中,若丙池中两电极产生的气体恰好相等时,理论上在乙池中精铜增加了___________ g。

(1)在电源中,B电极为
(2)在甲装置中,石墨(C)电极上发生
(3)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
(4)在丙装置中,X电极上发生的电极反应式是
(5)在此过程中,若丙池中两电极产生的气体恰好相等时,理论上在乙池中精铜增加了
您最近一年使用:0次
13-14高二·全国·单元测试
名校
解题方法
9 . (1)装置如图,打开K2,闭合K1。A极可观察到的现象是___ ;B极的电极反应为___ ,打开K1,闭合K2,A极可观察到的现象是_____ ;B极的电极反应为______ 。

(2)将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应为_____ ,电解反应的离子方程式为_____ , 实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积_____ L。


(2)将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应为

您最近一年使用:0次
2020-10-22更新
|
71次组卷
|
7卷引用:陕西省渭南市临渭区尚德中学2020-2021学年高二上学期第一次月考化学试题
解题方法
10 . (1)选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+CuSO4=ZnSO4+Cu。
①画出装置图:___ 。
②电极材料和电解质溶液各是什么___ 。?
③写出电极反应式:负极:___ ;正极:___ 。
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气___ L(标准状况下)。导线中通过___ mol电子。
①画出装置图:
②电极材料和电解质溶液各是什么
③写出电极反应式:负极:
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25克,铜表面析出了氢气
您最近一年使用:0次
2020-05-08更新
|
70次组卷
|
2卷引用:陕西省渭南市三贤中学2020年高一下学期期中考试化学试题



