10-11高三上·安徽蚌埠·期中
名校
解题方法
1 . 如图所示,杠杆A、B两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)

| A.杠杆为导体和绝缘体时,均为A端高B端低 |
| B.杠杆为导体和绝缘体时,均为A端低B端高 |
| C.当杠杆为绝缘体时,A端低B端高;当杠杆为导体时,A端高B端低 |
| D.当杠杆为绝缘体内,A端高B端低;当杠杆为导体时,A端低B端高 |
您最近一年使用:0次
2023-08-08更新
|
560次组卷
|
86卷引用:2011-2012学年湖北省襄阳市四校联考高一下学期期中考试化学试卷
(已下线)2011-2012学年湖北省襄阳市四校联考高一下学期期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高一下学期期中统考化学试卷2014-2015学年湖北省松滋一中高一下学期6月月考化学试卷2015-2016学年湖北省襄阳市老河口一中高一下期中化学试卷2015-2016学年湖北省枣阳市白水高中高一5月月考化学试卷2015-2016学年湖北省松滋一中高一下学期期末化学试卷湖北省黄冈市麻城市第二中学2021-2022学年高一下学期3月月考化学试题 (已下线)2011届安徽省蚌埠二中高三第一学期期中考试化学试卷(已下线)2010-2011学年河南省郑州一中高一下学期期末考前模拟化学试题(已下线)2012届浙江省慈溪市高三上学期期中考试化学试卷(已下线)2011-2012学年四川省成都铁中高二下学期2月学业检测化学试卷(已下线)2011-2012学年江西省铅山一中等四校高一下学期联考化学试卷(已下线)2011-2012学年江西省横峰中学高一下学期期中考试化学试卷(已下线)2011-2012学年浙江省衢州一中高一下学期期中检测化学试卷(已下线)2011-2012学年江苏省苏州五中高二第二学期期中考试化学试卷(已下线)2012-2013学年陕西省长安一中高一下学期期中考试化学试卷(已下线)2012-2013学年山东省微山县第一中学高一下学期期中考试化学试卷(已下线)2014年高一化学人教版必修2 模块水平检测2练习卷2014—2015江西省九江市彭泽县第二高中高一下学期期中考试化学试卷2015-2016学年宁夏中卫一中高二下第一次月考化学试卷2015-2016学年河北省邯郸市大名等四县高一下学期期中联考化学试卷2015-2016学年河北省枣强中学高一下期中化学试卷2015-2016学年浙江省杭州市七校高一下学期期中化学试卷2015-2016学年河北省邯郸市曲周一中高一下期中化学试卷2015-2016学年山西省太原五中高一下期末化学试卷2015-2016学年河北省石家庄市辛集中学高一下第一次段考化学试卷2016-2017学年福建省四地六校高二上第一次月考化学试卷甘肃省嘉峪关市第一中学2016-2017学年高一下学期期中考试化学试题四川省资阳中学2016-2017学年高一下学期期中化学试题河南省郑州市中牟县二中2017-2018学年高二第一次月考化学试题2018届高三一轮复习化学:微考点48-电池原理及其应用山西省忻州市第一中学2017-2018学年高二上学期摸底考试化学试题宁夏银川市六盘山高级中学2017-2018学年高二上学期第一次月考化学试题宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题《课时同步君》2017-2018学年高一化学人教必修2-2.2.2 发展中的化学电源(已下线)《周末培优君》2017-2018学年高一下学期化学-第06周 化学能与电能安徽省蚌埠市第二中学2017-2018学年高一下学期期中考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题2018-2019学年人教版高中化学选修四电化学基础章末综合测评题(四)【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第一次月考化学试题甘肃省兰州市第五十八中学2018-2019学年高二(理科)第一学期期末考试化学试题(已下线)考点09 原电池原理及其应用——备战2019年浙江新高考化学考点甘肃省武威市第六中学2018-2019学年高一下学期第二次学段考试化学试题重庆市第三十中学2018-2019学年高一5月月考化学试题【全国百强校】广东省中山市纪念中学2018~2019学年高一下学期第二次段考化学试题广东省广州大学附属东江中学2018-2019学年高一下学期期末考试化学试题浙江省东阳中学2019-2020学年高二上学期期中考试化学试题2019——2020学年人教版必修2 第二章 化学反应与能量【懂做原理题】2020届高三化学选修4二轮专题练——原电池的应用、双液原电池第二章 化学反应与能量学 综合拓展——B 拓展区 夯实基础(人教版必修2)第六章 化学反应与能量 综合拓展——B拓展区 夯实基础(人教版(2019)第二册)河北省邯郸市磁县第二中学2019-2020学年高一下学期期中考试化学试卷湖南省邵东县第一中学2019-2020学年高二下学期第一次月考化学试题山西省晋中市平遥中学2019-2020高一下学期在线学习质量检测化学试题河南省新安县第一高级中学2019-2020学年高一下学期5月月考化学试题甘肃省兰州市第一中学2019-2020学年高一下学期期中考试化学试题河北省石家庄市辛集市第二中学2019-2020学年高一下学期期末考试化学试题广西钦州市2019-2020学年高一下学期期末教学质量监测化学(理)试题云南省玉溪市峨山一中2020-2021学年高二上学期开学考试化学试题福建省连城县第一中学2020-2021学年高二上学期第一次月考化学试题必修第二册RJ第6章综合拓展(已下线)第四章 检测-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)吉林省白城市洮南市第一中学2020-2021学年高二上学期第三次月考化学试题人教版2019必修第二册 第六章 第一节 第2课时 化学反应与电能高中化学苏教2019版必修第二册-专题6 第三单元 第2课时 化学电源云南省保山第九中学2019-2020学年高二下学期期末考试化学试题黑龙江省大庆市实验中学实验一部2020-2021学年高一下学期4月阶段性教学质量检测化学试题山东省高密市第五中学2020-2021学年高一下学期4月月考化学试题(苏教版2019)必修第二册专题6 化学反应与能量变化 B 素养拓展区河北深州市长江中学2021-2022学年高二上学期10月月考化学(文)试题(已下线)第08讲 化学反应与电能(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)云南省曲靖市罗平县第五中学2021-2022学年高二4月月考化学试题安徽省蚌埠第三中学2021-2022学年高一下学期4月阶段测试化学试题黑龙江省双鸭山市集贤县2021-2022学年高一下学期期中考试化学试题内蒙古赤峰二中2021-2022学年高一下学期第二次月考化学试题江西省抚州市金溪县第一中学2021-2022学年高一下学期第二次月考化学试题辽宁省沈阳市新民市第一高级中学2020-2021学年高一下学期期中考试化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期5月月考化学试题河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题黑龙江省哈尔滨工业大学附属中学2022-2023学年高一下学期期末考试化学试题河北省邯郸市大名县第一中学2022-2023学年高一下学期3月月考化学试题云南迪庆藏族自治州民族中学2022-2023学年高一下学期期末考试化学试题第2课时 化学反应与电能(已下线)专题05 化学反应与能量变化(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)(已下线)期中测试卷二【测试范围:第五、六章】-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)6.1.2 化学反应与电能 随堂练习
2 . 某地区利用其自然资源建立的工业体系如下图所示。
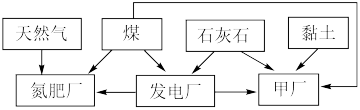
回答下列问题:
(1)“甲厂”为提高反应速率和原料的利用率,应先将石灰石进行___________ 处理。依据所使用的资源分析,“甲厂”的产品是___________ 。
(2)天然气中含有少量有害气体 ,常用NaOH溶液进行洗涤除去,反应的离子方程式为
,常用NaOH溶液进行洗涤除去,反应的离子方程式为___________ 。若改为使用三乙醇胺[N(CH2CH2OH)3]溶液洗涤,则每年节约资金可达百万元。已知在常温下三乙醇胺为液体,沸点为380℃,与 的反应为
的反应为 。解释能节约资金的原因
。解释能节约资金的原因___________ 。
(3)煤中含有一定量 。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为
。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为___________ 。后来改为在煤燃烧前,用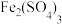 溶液溶解煤中的
溶液溶解煤中的 进行脱硫,写出反应化学方程式
进行脱硫,写出反应化学方程式___________ 。
(4)氮肥厂产生的“氨氮”废水中含有铵盐,直接排放会产生水体污染。传统的处理方法有多种。近年,电化学处理“氨氮”废水成为了研究热点,其中的一种原理如下图所示。
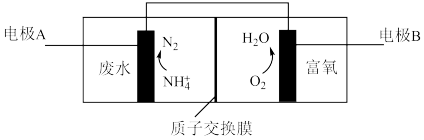
①检验废水中含有 的操作是
的操作是___________ 。
②电极B是___________ 极。
③写出电极A上发生的电极反应式___________ 。

回答下列问题:
(1)“甲厂”为提高反应速率和原料的利用率,应先将石灰石进行
(2)天然气中含有少量有害气体
 ,常用NaOH溶液进行洗涤除去,反应的离子方程式为
,常用NaOH溶液进行洗涤除去,反应的离子方程式为 的反应为
的反应为 。解释能节约资金的原因
。解释能节约资金的原因(3)煤中含有一定量
 。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为
。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为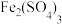 溶液溶解煤中的
溶液溶解煤中的 进行脱硫,写出反应化学方程式
进行脱硫,写出反应化学方程式(4)氮肥厂产生的“氨氮”废水中含有铵盐,直接排放会产生水体污染。传统的处理方法有多种。近年,电化学处理“氨氮”废水成为了研究热点,其中的一种原理如下图所示。

①检验废水中含有
 的操作是
的操作是②电极B是
③写出电极A上发生的电极反应式
您最近一年使用:0次
解题方法
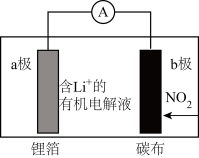
3 . 我国研究的新型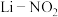 电池,为
电池,为 的治理和再利用提供了新的研究思路,其工作原理如图所示。电池放电时的总反应为
的治理和再利用提供了新的研究思路,其工作原理如图所示。电池放电时的总反应为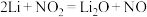 。下列有关该电池工作时的说法不正确的是
。下列有关该电池工作时的说法不正确的是
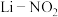 电池,为
电池,为 的治理和再利用提供了新的研究思路,其工作原理如图所示。电池放电时的总反应为
的治理和再利用提供了新的研究思路,其工作原理如图所示。电池放电时的总反应为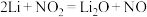 。下列有关该电池工作时的说法不正确的是
。下列有关该电池工作时的说法不正确的是
| A.外电路电流的方向:b极→电流表→a极 |
B.b极的电极反应: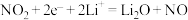 |
| C.当外电路通过1mol电子时,b极质量增加15g |
D.电解液中 向a极附近迁移 向a极附近迁移 |
您最近一年使用:0次
2022-11-16更新
|
290次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2022-2023学年高二上学期期中联考化学试题
名校
解题方法
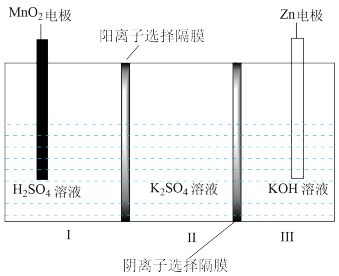
4 . 一种水性电解液 离子选择双隔膜电池如图所示[
离子选择双隔膜电池如图所示[ 溶液中,
溶液中, 以
以 存在]。电池放电时,下列叙述正确的是
存在]。电池放电时,下列叙述正确的是
 离子选择双隔膜电池如图所示[
离子选择双隔膜电池如图所示[ 溶液中,
溶液中, 以
以 存在]。电池放电时,下列叙述正确的是
存在]。电池放电时,下列叙述正确的是
A.电子由Zn电极经电解质溶液流向 电极 电极 |
B.Ⅲ区的 通过隔膜向Ⅱ区迁移 通过隔膜向Ⅱ区迁移 |
C. 电极反应式: 电极反应式: |
D.若将离子选择隔膜位置交换,Ⅱ区 溶液浓度降低 溶液浓度降低 |
您最近一年使用:0次
2022-11-13更新
|
320次组卷
|
3卷引用:湖北省宜昌市协作体2022-2023学年高三上学期期中考试化学试题
名校
解题方法
5 . 一种混合水性 可充电电池的能量密度较传统锂电池有明显提高,其放电时工作原理如图所示。下列叙述正确的是
可充电电池的能量密度较传统锂电池有明显提高,其放电时工作原理如图所示。下列叙述正确的是

 可充电电池的能量密度较传统锂电池有明显提高,其放电时工作原理如图所示。下列叙述正确的是
可充电电池的能量密度较传统锂电池有明显提高,其放电时工作原理如图所示。下列叙述正确的是
A.放电刚开始,电池负极材料为Zn,正极材料为 |
B.充电过程中K+通过离子交换膜移向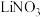 溶液 溶液 |
C.放电过程总反应: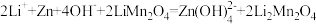 |
D.充电时电路中每通过 ,理论上可使 ,理论上可使 电极增重1.4g 电极增重1.4g |
您最近一年使用:0次
2022-11-05更新
|
1061次组卷
|
3卷引用:湖北省武汉市洪山区武汉西藏中学2023-2024学年高三上学期1月期末理综试题-高中化学
解题方法
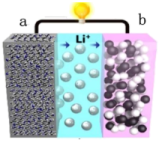
6 . 锂离子电池应用广泛,某课题组使用纳米Si-C复合颗粒直接与锂接触,形成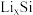 ,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与
,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与 电极匹配组成如图所示原电池。该电池的总反应为
电极匹配组成如图所示原电池。该电池的总反应为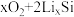
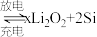 ,下列说法
,下列说法正确的是
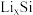 ,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与
,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与 电极匹配组成如图所示原电池。该电池的总反应为
电极匹配组成如图所示原电池。该电池的总反应为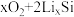
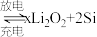 ,下列说法
,下列说法
| A.该电池放电时,a为正极 |
B.充电和放电过程,电解液中 浓度都会改变 浓度都会改变 |
C.放电时,当负极质量减少14g时,电解液中转移1mol |
D.电池充电时,阳极的电极反应为 |
您最近一年使用:0次
解题方法
7 . 下列有关甲、乙两种电池的说法中正确的是
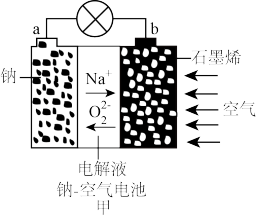
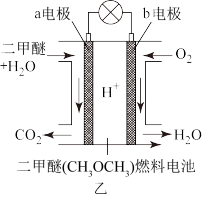


| A.甲:电池工作时化学能全部转化为电能 |
| B.甲:电解液不可能采用氢氧化钠水溶液 |
| C.乙:电池工作时,电子从a电极→灯泡→b电极→电解液→a电极 |
| D.乙:正极电极反应式为CH3OCH3-12e- + 3H2O=2CO2 +12H+ |
您最近一年使用:0次
2022-09-14更新
|
145次组卷
|
2卷引用:湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题
名校
解题方法
8 . 某课题组利用盐度梯度和氧化还原工艺,成功的设计了下图所示的电池装置,将酸性废水中存在的高毒性 转化为低毒性Cr3+。下 列说法正确的是
转化为低毒性Cr3+。下 列说法正确的是

 转化为低毒性Cr3+。下 列说法正确的是
转化为低毒性Cr3+。下 列说法正确的是 
| A.该装置为电解池,能量由电能转化为化学能 |
| B.左边电极反应式为: Cr(Ⅵ) +3e- =Cr(Ⅲ) |
| C.电池利用溶液盐度梯度产生电动势,C2表示低浓度盐溶液 |
D.若产生6.72L氧气,则理论上转化0.2 mol  |
您最近一年使用:0次
名校
解题方法
9 . 人们应用原电池原理制作了多种电池,广泛使用于日常生活、生产和科学技术等方面,以满足不同的需要。请按要求回答下列问题:
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
①Li—CuO二次电池的比能量高、工作温度宽。Li—CuO二次电池中,放电时金属锂作____ 极。比能量是指消耗单位质量的电极所释放的电量,可用来衡量电池的优劣,则Li、Na、Al分别作为电极时比能量由大到小的顺序为____ 。
②一种制备CuO的过程如图:

“酸浸反应”中,H2O2作____ (填“氧化剂”或“还原剂”)。写出“混合沉淀”过程产生Cu2(OH)2CO3反应的离子方程式:____ 。
(2)CH3OH可作为燃料使用,使用CH3OH和O2组合设计的燃料电池的结构如图所示,电池总反应为2CH3OH+3O2=2CO2+4H2O,质子(H+)交换膜左右两侧的溶液均为等浓度的稀硫酸。

①物质a为____ (填化学式);电极c上发生的电极反应为____ 。
②电极d为____ 极,电极d上发生的电极反应为____ 。
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
①Li—CuO二次电池的比能量高、工作温度宽。Li—CuO二次电池中,放电时金属锂作
②一种制备CuO的过程如图:

“酸浸反应”中,H2O2作
(2)CH3OH可作为燃料使用,使用CH3OH和O2组合设计的燃料电池的结构如图所示,电池总反应为2CH3OH+3O2=2CO2+4H2O,质子(H+)交换膜左右两侧的溶液均为等浓度的稀硫酸。

①物质a为
②电极d为
您最近一年使用:0次
2022-05-03更新
|
253次组卷
|
3卷引用:湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题
名校
解题方法
10 . 银器日久表面因生成Ag2S而逐渐变黑。利用原电池原理处理的方法是在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色褪去。下列说法正确的是
| A.铝作正极,银作负极 |
| B.负极上发生还原反应 |
| C.Ag2S在正极得到电子 |
| D.工作时电能转化为化学能 |
您最近一年使用:0次
2022-04-22更新
|
1071次组卷
|
5卷引用:湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题



