1 . 近代化学发展的里程碑中,下列科学家与其成就不相对应的是
| A.1661年波义耳提出原子学说,标志着近代化学的诞生 |
| B.1774年拉瓦锡提出燃烧的氧化学说,使近代化学取得了革命性的进展 |
| C.1869年门捷列夫发现元素周期律,使化学的研究变得有规律可循 |
| D.1943年侯德榜发明联合制碱法,为我国的化学工业发展和技术创新作出了重要贡献 |
您最近一年使用:0次
2 . 某元素X的最高价氧化物为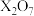 ,则它的气态氢化物是
,则它的气态氢化物是
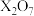 ,则它的气态氢化物是
,则它的气态氢化物是A. | B. | C. | D. |
您最近一年使用:0次
2021-07-22更新
|
494次组卷
|
7卷引用:黑龙江省齐齐哈尔三立高级中学2021-2022学年高二上学期期初考化学试题
名校
解题方法
3 . 下列说法正确的是
| A.原子核外各电子层最多能容纳的电子数为n2 |
| B.同一主族中,第三周期和第四周期元素原子的核电荷数都相差8 |
| C.位于第四周期第IVA族的元素为金属元素 |
| D.门捷列夫在1869年提出了元素的性质随着原子序数的递增而呈周期性变化的规律 |
您最近一年使用:0次
2021-03-05更新
|
226次组卷
|
4卷引用:黑龙江省哈尔滨第六中学2020-2021学年高二下学期期中考试化学试题
黑龙江省哈尔滨第六中学2020-2021学年高二下学期期中考试化学试题(已下线)期中检测卷3-2020-2021学年高一化学必修2章末集训必刷卷(人教版)浙江省绍兴市柯桥区2020届高三适应性考试化学试题(已下线)【绍兴新东方】绍兴高中化学00014
20-21高一上·全国·课时练习
名校
4 . 元素的性质呈周期性变化的根本原因是
| A.相对原子质量递增,量变引起质变 | B.原子半径呈周期性变化 |
| C.原子核外电子排布呈周期性变化 | D.元素的最高正化合价呈周期性变化 |
您最近一年使用:0次
2020-12-12更新
|
509次组卷
|
4卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一上学期期末考试化学试题
黑龙江省鹤岗市第一中学2020-2021学年高一上学期期末考试化学试题(已下线)专题4.2.1 元素性质的周期性变化规律(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)吉林省长春外国语学校2020-2021学年高一上学期期末考试(文科)化学试题(已下线)4.2.1 元素性质的周期性变化规律(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)
名校
解题方法
5 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中的原子序数依次增大的同主族元素。回答下列问题:
(1)N2的电子式为_________ ;锑在元素周期表中的位置为__________ 。
(2) 中子数与质子数的差值为
中子数与质子数的差值为________ 。
(3)酸性:H3AsO4__ H3PO4(填“>”或”<”)请从元素性质角度解释原因_______ 。
(4)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性,可用于化学镀银。
①H3PO2与足量的NaOH溶液反应生成NaH2PO2,则H3PO2是______ 元酸(填“一”、“二”或“三”)。
②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行镀银时,氧化剂与还原剂的物质的量之比为__ 。
(1)N2的电子式为
(2)
 中子数与质子数的差值为
中子数与质子数的差值为(3)酸性:H3AsO4
(4)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性,可用于化学镀银。
①H3PO2与足量的NaOH溶液反应生成NaH2PO2,则H3PO2是
②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行镀银时,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
2020-06-04更新
|
264次组卷
|
2卷引用:黑龙江省哈尔滨市第十三中学2020-2021学年高一上学期期末考试化学(理)试题
9-10高一下·福建厦门·期末
名校
6 . 元素性质呈现周期性变化的根本原因是
| A.元素的相对原子质量递增,量变引起质变 |
| B.元素原子的核外电子排布呈周期性变化 |
| C.元素的原子半径呈周期性变化 |
| D.元素的化合价呈周期性变化 |
您最近一年使用:0次
2016-12-09更新
|
276次组卷
|
22卷引用:黑龙江省哈尔滨市延寿县第二中学2020-2021学年高一下学期3月月考化学试题
黑龙江省哈尔滨市延寿县第二中学2020-2021学年高一下学期3月月考化学试题(已下线)2011-2012年黑龙江大庆铁人中学高一下学期期中考试化学试卷(已下线)2010年福建省厦门市高一下学期质量检测化学试题(已下线)2010年甘肃省民乐一中高二第二学期期末考试化学试题(已下线)2010—2011学年内蒙古集宁一中高一下学期期中考试化学试卷(已下线)2010—2011学年福建省三明二中高一下期期中考试化学试卷(已下线)2011-2012学年内蒙古包头三十三中高一下学期期中考试化学试卷(已下线)2011-2012学年湖南省望城一中高一下学期期中考试化学试卷(已下线)2011-2012学年福建省福州文博中学高一下学期期中考试化学试卷(已下线)2014届湖南浏阳一中高一下学期期中考试化学(理)试卷2015-2016学年云南省开远四中高一下学期期中化学试卷江西省南昌市八一中学、洪都中学、麻丘中学、十七中、桑海中学2016-2017学年高一下学期期中考试化学试题湖南省师范大学附属中学2016-2017学年高一下学期期末考试化学试题【全国百强校】上海市金山中学2017-2018学年高二上学期期中考试等级化学试题吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题安徽省白泽湖中学2018-2019学年高一下学期第一次月考化学试题新疆自治区北京大学附属中学新疆分校2018-2019学年高一下学期期中考试化学试题2020届高三化学知识点强化训练-元素周期律陕西省西安中学2019-2020学年高一下学期期中考试(平行班)化学试题湖南省衡阳市衡东县欧阳遇实验中学2019-2020学年高一上学期期末考试化学试题浙江省嘉兴市第五高级中学2018-2019学年高一下学期期中考试化学试题新疆克孜勒苏柯尔克孜自治州2021-2022学年高一下学期期中考试化学试题



