1 . 下列说法正确的是
①熔融能导电的物质是电解质
②氧化还原反应的实质是电子的转移
③元素性质周期性变化的根本原因是原子半径的周期性变化
④复分解反应通常向着溶液中某些离子浓度减少的方向进行
⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物
①熔融能导电的物质是电解质
②氧化还原反应的实质是电子的转移
③元素性质周期性变化的根本原因是原子半径的周期性变化
④复分解反应通常向着溶液中某些离子浓度减少的方向进行
⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物
| A.①②④ | B.②④⑤ | C.①③⑤ | D.③④⑤ |
您最近半年使用:0次
2 . 为近代化学奠定了坚实的基础是
| A.道尔顿提出原子学说 | B.拉瓦锡建立氧化学说 |
| C.波义耳提出化学元素的概念 | D.门捷列夫发现元素周期律 |
您最近半年使用:0次
名校
3 . 下表是元素周期表的一部分,a~k分别代表10种元素,请回答:
(1)元素a~k中,其简单氢化物最稳定的是_____ (填元素符号)。
(2)b的简单氢化物的结构式_____ 。
(3)c、d、e、f中形成的简单离子半径由大到小的顺序是_____ (填离子符号)。
(4)写出两种由c原子和e原子构成的化合物的电子式_____ 。
(5)元素h、i的最高价氧化物对应水化物中酸性较强的是_____ (填化学式)。
(6)写出84号元素在元素周期表中的位置_____ 。
(7)g的单质与e的最高价氧化物对应的水化物反应的化学方程式是_____ 。
(8)下列说法能证明金属性k强于f的是_____ (填序号)。
A.k的简单阳离子的氧化性更弱
B.k的氢氧化物水溶液的导电性更强
C.k的单质与水反应更剧烈
| a | ||||||||
| b | c | d | ||||||
| e | f | g | h | i | ||||
| k | …… | |||||||
(2)b的简单氢化物的结构式
(3)c、d、e、f中形成的简单离子半径由大到小的顺序是
(4)写出两种由c原子和e原子构成的化合物的电子式
(5)元素h、i的最高价氧化物对应水化物中酸性较强的是
(6)写出84号元素在元素周期表中的位置
(7)g的单质与e的最高价氧化物对应的水化物反应的化学方程式是
(8)下列说法能证明金属性k强于f的是
A.k的简单阳离子的氧化性更弱
B.k的氢氧化物水溶液的导电性更强
C.k的单质与水反应更剧烈
您最近半年使用:0次
解题方法
4 . 元素周期表是元素周期律的必然产物,根据元素位置预测元素性质是周期表的用途之一。元素周期律的实质是
| A.原子半径的周期性变化 | B.元素主要化合价的周期性变化 |
| C.核外电子排布的周期性变化 | D.原子序数的递增 |
您最近半年使用:0次
解题方法
5 . 元素周期表的建立和元素周期律的发现,特别是原子结构的奥秘被揭示,对人们从微观角度探索元素之间的内在联系,认识元素性质及其递变规律起到不可替代的作用。回答下列问题:
(1)元素性质周期性变化的根本原因是________ (填字母)。
a.原子核内中子数的变化 b.元素的相对原子质量逐渐增大
c.原子核外电子排布呈周期性变化 d.元素化合价呈周期性变化
(2)如图为元素周期表的一部分。按要求填空:
①以上元素对应的单质中,化学性质最稳定的是________ (填元素符号);最易与H2发生化合反应的单质是______ (填化学式)。
②Cl在元素周期表中的位置是______ ;Cl的最高价氧化物对应水化物的酸性比H2SO4______ (填“强”或“弱”),其电离方程式为_________ 。
③上表中第三周期元素对应的简单离子半径最大的是_______ (填离子符号);Na的最高价氧化物对应水化物与AI的最高价氧化物对应水化物反应的离子方程式为________ 。
(1)元素性质周期性变化的根本原因是
a.原子核内中子数的变化 b.元素的相对原子质量逐渐增大
c.原子核外电子排布呈周期性变化 d.元素化合价呈周期性变化
(2)如图为元素周期表的一部分。按要求填空:
| C | N | F | Ne | ||||
| Na | Al | S | Cl |
②Cl在元素周期表中的位置是
③上表中第三周期元素对应的简单离子半径最大的是
您最近半年使用:0次
23-24高二·全国·假期作业
解题方法
6 . 元素原子的核外电子排布呈现周期性变化是形成元素周期系的根本原因。(_____)
您最近半年使用:0次
名校
解题方法
7 . 根据元素周期表中第三周期元素知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___________。
(2)原子最外层电子数与次外层中p能级电子数相同的元素名称是___________ ,原子核外电子总数是最外层电子数3倍的元素原子价电子排布式是___________ 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是___________ ;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
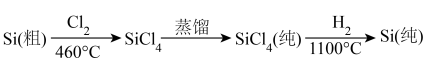
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________ 。
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:___________ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___________。
| A.原子半径和简单离子半径均减小 | B.金属性减弱,非金属性增强 |
| C.氧化物对应的水化物碱性减弱,酸性增强 | D.单质的熔点降低 |
(2)原子最外层电子数与次外层中p能级电子数相同的元素名称是
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
您最近半年使用:0次
名校
解题方法
8 . 哲学的“对立统一”规律广泛存在于化学反应中。下列所述不符合“对立统一”规律的是
| A.氧化还原反应中氧化产物和还原产物同时生成 |
| B.元素性质随原子序数递增而发生周期性变化 |
| C.在原电池中正极反应和负极反应同时发生 |
D.HI、 、 、 体系中既存在HI的分解,同时又存在HI的生成 体系中既存在HI的分解,同时又存在HI的生成 |
您最近半年使用:0次
2024-01-08更新
|
39次组卷
|
2卷引用:河北省廊坊市廊坊部分重点高中2023-2024学年高三上学期11月期中化学试题
名校
9 . 下列说法不正确的是
| A.在研究氯气的性质时,闻到有刺激性气味,该过程使用了观察法 |
| B.观察是用感官来研究物质的性质,可以借助仪器 |
| C.人们可以利用先进的技术和设备通过化学变化制造出新的原子和新的分子 |
| D.门捷列夫发现了元素周期律,把化学元素及其化合物纳入一个统一的理论体系 |
您最近半年使用:0次



