名校
解题方法
1 . 元素及其化合物的性质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的。肼可用作火箭燃料,燃烧时发生的反应是 。若该反应中有4molN—H键断裂,则形成的π键有
。若该反应中有4molN—H键断裂,则形成的π键有_______ mol。
(2)氯化溴(BrCl)的化学性质类似于卤素单质,写出BrCl与水反应的化学方程式_______ 。
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是_______ (写出名称)。
(4)已知下列5种羧酸,①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH其酸性由强到弱的顺序为_______ (填序号)。
(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是_______ (填“极性”或“非极性”)分子。
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。
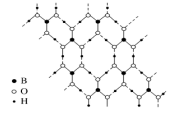
则1molH3BO3形成的晶体中有_______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,其中B原子的杂化方式是_______ 。
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的。肼可用作火箭燃料,燃烧时发生的反应是
 。若该反应中有4molN—H键断裂,则形成的π键有
。若该反应中有4molN—H键断裂,则形成的π键有(2)氯化溴(BrCl)的化学性质类似于卤素单质,写出BrCl与水反应的化学方程式
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能/(kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)已知下列5种羧酸,①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH其酸性由强到弱的顺序为
(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。

则1molH3BO3形成的晶体中有
您最近一年使用:0次



