名校
1 . 用如图所示实验装置进行相关实验探究,实验设计合理并能达到实验目的的是
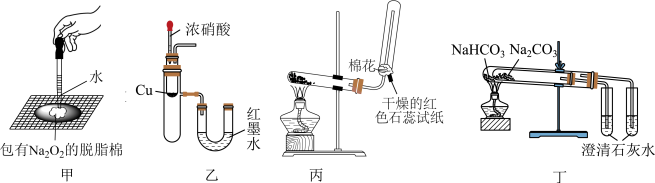

| A.装置甲验证Na2O2与水反应放热 |
| B.装置乙验证Cu与浓硝酸反应的热量变化 |
| C.装置丙制取并收集、检验氨气 |
| D.装置丁比较Na2CO3与NaHCO3的稳定性 |
您最近一年使用:0次
2023-09-15更新
|
386次组卷
|
2卷引用:山东省枣庄市第八中学2022-2023学年高一上学期期末考试化学试题
22-23高一下·上海浦东新·期中
名校
解题方法
2 . 下图是某同学设计的木炭和浓硫酸反应并检验所得产物的实验装置。
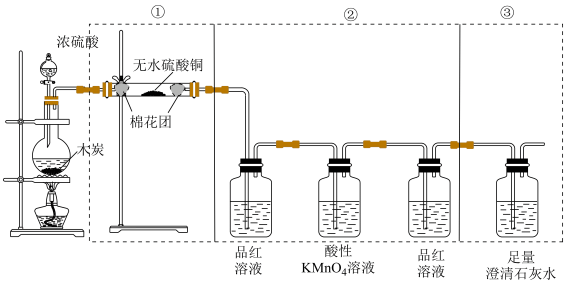
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:___________ 。
(2)②中酸性 溶液的作用是
溶液的作用是___________ ,第二瓶品红溶液的作用是___________ 。
(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是______ ;不能检出的物质是________ 。
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是___________ ;不能检出的物质是___________ 。
(5)有同学希望通过测量③中装置质量的增加来计算反应的木炭的质量,则在②③之间插入一个洗气瓶,其中装___________ (填写试剂名称)。

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(2)②中酸性
 溶液的作用是
溶液的作用是(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是
(5)有同学希望通过测量③中装置质量的增加来计算反应的木炭的质量,则在②③之间插入一个洗气瓶,其中装
您最近一年使用:0次
名校
解题方法
3 . 木炭与浓H2SO4加热反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。为检验该反应的三种产物,某课外兴趣小组设计了如下装置进行实验(夹持装置未画出)。
CO2↑+2SO2↑+2H2O。为检验该反应的三种产物,某课外兴趣小组设计了如下装置进行实验(夹持装置未画出)。
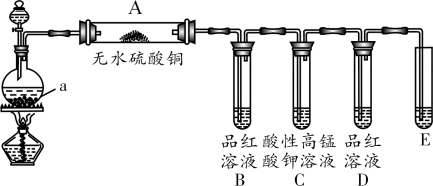
请回答下列问题:
(1)仪器a的名称是___________ 。
(2)装置A中观察到的现象是___________ 。
(3)装置C的作用是___________ 。
(4)装置E中的试剂为___________ ,用于检验___________ 。
 CO2↑+2SO2↑+2H2O。为检验该反应的三种产物,某课外兴趣小组设计了如下装置进行实验(夹持装置未画出)。
CO2↑+2SO2↑+2H2O。为检验该反应的三种产物,某课外兴趣小组设计了如下装置进行实验(夹持装置未画出)。
请回答下列问题:
(1)仪器a的名称是
(2)装置A中观察到的现象是
(3)装置C的作用是
(4)装置E中的试剂为
您最近一年使用:0次
名校
解题方法
4 . 盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室必备的重要试剂
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有___________ 性;硝酸应保存在棕色瓶中,这是因为硝酸具有___________ 性。
(2)如图是硫酸试剂瓶标签上的部分内容,该硫酸的浓度是___________ ;实验人员操作时不必需穿戴的安全用具是___________ 。
A.防护手套 B.实验服 C.防毒面具 D.护目镜
(3)在稀硝酸溶液中加入铜片使之充分反应,写出反应的离子方程式_________________ 。
(4)实验室中向烧杯内加入约20g蔗糖,向其中插入玻璃棒,滴加几滴蒸馏水,再加入适量浓硫酸。白色的蔗糖变为疏松多孔的黑色物质,放出大量的热使烧杯壁发烫。验证产生的气体有SO2的方法是___________________ ,验证该气体中还含有CO2的方法是_______________________ 。
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有
(2)如图是硫酸试剂瓶标签上的部分内容,该硫酸的浓度是
| 化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数: 98.9% |
(3)在稀硝酸溶液中加入铜片使之充分反应,写出反应的离子方程式
(4)实验室中向烧杯内加入约20g蔗糖,向其中插入玻璃棒,滴加几滴蒸馏水,再加入适量浓硫酸。白色的蔗糖变为疏松多孔的黑色物质,放出大量的热使烧杯壁发烫。验证产生的气体有SO2的方法是
您最近一年使用:0次
2023-04-23更新
|
73次组卷
|
2卷引用:江西省吉安市第三中学2022-2023学年高一下学期6月期末考试化学试题
解题方法
5 . 用石墨作电极电解稀 溶液的装置(如图),电解液中事先加有指示剂,此时溶液呈红色(指示剂变色的pH范围是6.8~8.0,酸性溶液中呈红色,碱性溶液中呈黄色)。下列判断正确的是
溶液的装置(如图),电解液中事先加有指示剂,此时溶液呈红色(指示剂变色的pH范围是6.8~8.0,酸性溶液中呈红色,碱性溶液中呈黄色)。下列判断正确的是
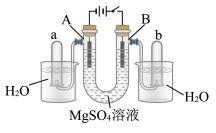
 溶液的装置(如图),电解液中事先加有指示剂,此时溶液呈红色(指示剂变色的pH范围是6.8~8.0,酸性溶液中呈红色,碱性溶液中呈黄色)。下列判断正确的是
溶液的装置(如图),电解液中事先加有指示剂,此时溶液呈红色(指示剂变色的pH范围是6.8~8.0,酸性溶液中呈红色,碱性溶液中呈黄色)。下列判断正确的是
| A.电解过程中,A管溶液由红色变为黄色 |
| B.电解过程中,B管溶液由红色变为黄色 |
C.A管中发生的电极反应为 |
| D.用拇指堵住b管口,取出b管,靠近火焰,移开拇指,有爆鸣声,管口有蓝色火焰 |
您最近一年使用:0次
名校
解题方法
6 . 已知硫酸亚铁铵[ ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ (填化学式)。
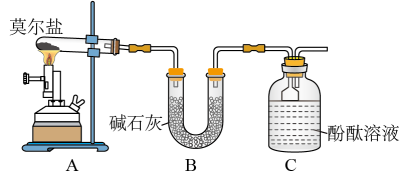
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。
①乙同学的实验中,装置依次连按的合理顺序为:A→H→→→→G。_______
②证明含有 的实验现象是
的实验现象是_______ 。
Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。
乙方案(通过 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
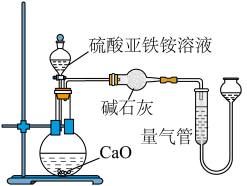
请回答:
(3)乙方案中量气管中最佳试剂是_______ 。
a. 水 b. 饱和 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液
(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_______ 。
(5)若测得 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为_______ (列出计算式)。
 ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有
 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。 | 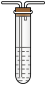 |  | 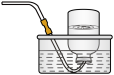 |  |
| D. 品红溶液 | E.  溶液 溶液 | F.  溶液和足量盐酸 溶液和足量盐酸 | G. 排水集气法 | H.安全瓶 |
②证明含有
 的实验现象是
的实验现象是Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成
 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取
 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。乙方案(通过
 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是
a. 水 b. 饱和
 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(5)若测得
 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次
2023-01-21更新
|
754次组卷
|
3卷引用:山东省青岛第五十八中学2022-2023学年高一上学期期末考试化学试题
解题方法
7 . 氯元素能与许多元素形成种类繁多的化合物,这些含氯化合物在生活及工农业生产中发挥着重要的作用。
(1)从海水中获取粗盐的方法是_______ 。
(2)利用电解饱和食盐水可以制备氢气、氯气、氢氧化钠。电解时阳极产物为_______ ,该产物的检验方法为_______ 。
(3)工业上用氯气和消石灰反应制备漂白粉,其有效成分是_______ (填化学式);写出漂白粉露置在空气中失效过程中所涉及的化学方程式:_______ 、_______ 。
(4)H2与Cl2在点燃条件下可以制取HCl。某同学对HCl性质进行如下预测:
①从物质类别上看,HCl属于酸,其水溶液能与碳酸钙反应,相应的离子方程式为_______ 。
②从化合价角度看,HCl中的Cl元素显-1价,处于氯元素的最低价,因此-1价的Cl元素在反应中可以被_______ (选填“氧化”或“还原”),在一定条件下能与_______ 发生氧化还原反应(填编号)。
a.KI b.NaOH c.KMnO4
(5)已知HClO4是强酸,HClO4在水中的电离方程式为_______ 。
(1)从海水中获取粗盐的方法是
(2)利用电解饱和食盐水可以制备氢气、氯气、氢氧化钠。电解时阳极产物为
(3)工业上用氯气和消石灰反应制备漂白粉,其有效成分是
(4)H2与Cl2在点燃条件下可以制取HCl。某同学对HCl性质进行如下预测:
①从物质类别上看,HCl属于酸,其水溶液能与碳酸钙反应,相应的离子方程式为
②从化合价角度看,HCl中的Cl元素显-1价,处于氯元素的最低价,因此-1价的Cl元素在反应中可以被
a.KI b.NaOH c.KMnO4
(5)已知HClO4是强酸,HClO4在水中的电离方程式为
您最近一年使用:0次
名校
8 . SO2虽是大气污染物之一,但也是重要的工业原料。某同学在实验室设计了如下实验,对SO2的部分性质进行了探究。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是_______ (结合有关平衡方程式简要说明)。
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。
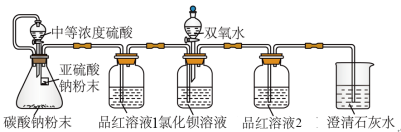
(2)加入碳酸钠粉末的目的是_______ 。
(3)当_______ 时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是_______ 。
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为_______ 。
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若_______ ,说明还原性:SO2>I-,写出该反应的离子方程式:_______ 。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。

(2)加入碳酸钠粉末的目的是
(3)当
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若
您最近一年使用:0次
2022-12-31更新
|
305次组卷
|
2卷引用:河南省驻马店市2022-2023学年高三上学期1月期末测试化学试题
9 . 铁与水蒸气反应的实验装置如图所示,下列有关该实验的说法不正确 的是
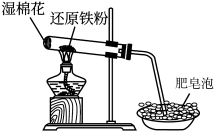

| A.湿棉花的作用是提供水蒸气 |
B.每消耗3mol ,生成4mol ,生成4mol |
| C.点燃酒精灯产生肥皂泡,证明发生了反应 |
D.铁与水蒸气反应生成的固体产物是 |
您最近一年使用:0次
名校
解题方法
10 . 下列实验报告记录的实验现象正确的是( )
| 实验 | 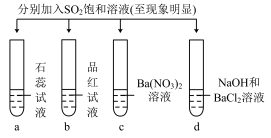 | ||||
| 记录 | a | b | c | d | |
| A | 无色 | 无色 | 无现象 | 无色溶液 | |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-19更新
|
238次组卷
|
5卷引用:吉林省辽源市田家炳高中友好学校2022-2023学年高一下学期7月期末联考化学试题



