名校
解题方法
1 . 金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是______ 。
(2)金属镁可以用来生产金属铀(元素符号是U): ,该反应中,作为还原剂的物质是
,该反应中,作为还原剂的物质是______ (填化学式,下同),被还原的物质是______ 。
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
由实验1和实验2得出的结论是:金属性,______ >______ >______ (填元素符号),用原子结构理论解释:同周期元素从左到右,______ 。
(4)写出Na和Al最高价氧化物的水化物相互反应的离子反应方程式______ 。
(1)Al在元素周期表中的位置是
(2)金属镁可以用来生产金属铀(元素符号是U):
 ,该反应中,作为还原剂的物质是
,该反应中,作为还原剂的物质是(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
| 实验1 | 实验2 |
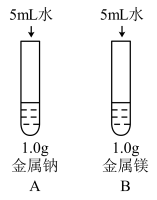 |  |
| 钠与水反应剧烈,镁与水反应缓慢 | 镁与盐酸反应剧烈,铝与盐酸反应缓慢 |
由实验1和实验2得出的结论是:金属性,
(4)写出Na和Al最高价氧化物的水化物相互反应的离子反应方程式
您最近一年使用:0次
2022-12-14更新
|
92次组卷
|
2卷引用:新疆伊宁市第八中学2021-2022学年高一上学期期末考试化学试题
2 . 亚硫酸钠( )是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究
)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 的性质,进行了如下实验。
的性质,进行了如下实验。
【性质预测】
(1) 中硫元素的化合价是
中硫元素的化合价是_______ 价,属于S元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下, 被还原为
被还原为 。
。
【分析解释】
(2)实验i中,反应的离子方程式是_______ 。
【继续探究】
(3)甲同学认为实验ii的现象不能直接得出“ 具有氧化性”。
具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设a:酸性溶液中的 具有氧化性,可产生S;
具有氧化性,可产生S;
假设b:空气中存在 ,在酸性条件下,由于
,在酸性条件下,由于_______ (用离子方程式表示),可产生S;
假设c:酸性溶液中的 具有氧化性,可产生S。
具有氧化性,可产生S。
②设计实验iii证实了假设a和b不是产生S的主要原因。
实验iii:向 溶液中加入
溶液中加入_______ (填试剂名称),产生有臭鸡蛋气味的气体,溶液未变浑浊。
(4)结合实验ii和iii,用离子方程式解释实验ii中产生淡黄色浑浊的原因:_______ 。
 )是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究
)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 的性质,进行了如下实验。
的性质,进行了如下实验。【性质预测】
(1)
 中硫元素的化合价是
中硫元素的化合价是【实验验证】
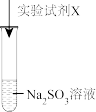 | 实验序号 | 实验试剂X | 实验现象 |
| i |  溶液、稀硫酸 溶液、稀硫酸 | 紫色褪去 | |
| ii |  溶液、稀硫酸 溶液、稀硫酸 | 加入 溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊 溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊 |
资料:酸性条件下,
 被还原为
被还原为 。
。【分析解释】
(2)实验i中,反应的离子方程式是
【继续探究】
(3)甲同学认为实验ii的现象不能直接得出“
 具有氧化性”。
具有氧化性”。①对淡黄色浑浊产生的原因作出如下假设:
假设a:酸性溶液中的
 具有氧化性,可产生S;
具有氧化性,可产生S;假设b:空气中存在
 ,在酸性条件下,由于
,在酸性条件下,由于假设c:酸性溶液中的
 具有氧化性,可产生S。
具有氧化性,可产生S。②设计实验iii证实了假设a和b不是产生S的主要原因。
实验iii:向
 溶液中加入
溶液中加入(4)结合实验ii和iii,用离子方程式解释实验ii中产生淡黄色浑浊的原因:
您最近一年使用:0次
3 . 物质的类别和元素的化合价是研究物质性质的两个重要角度。请根据如图所示信息,回答下列问题:

(1)欲制备 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是_______ (填标号)。
a. b.
b. c.
c. d.
d.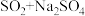
(2)Y可使品红溶液褪色,说明Y具有_______ 。
(3)图为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

Ⅰ.想要立即终止①的反应,最恰当的方法是_______ (填标号)。
a.撤去酒精灯b.拔去橡胶塞倒出溶液c.上移铜丝,使其脱离溶液
将反应后试管①中的溶液慢慢倒入到水中,发生的变化是_______ 。
Ⅱ.装置④溶液中发生的离子反应方程式_______ 。
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式_______ 。

(1)欲制备
 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是a.
 b.
b. c.
c. d.
d.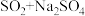
(2)Y可使品红溶液褪色,说明Y具有
(3)图为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

Ⅰ.想要立即终止①的反应,最恰当的方法是
a.撤去酒精灯b.拔去橡胶塞倒出溶液c.上移铜丝,使其脱离溶液
将反应后试管①中的溶液慢慢倒入到水中,发生的变化是
Ⅱ.装置④溶液中发生的离子反应方程式
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式
您最近一年使用:0次
4 . 氯及其化合物既是重要化工原料,又是高效、广谱消毒剂。
(1)漂白粉是常见的消毒剂,写出工业制取漂白粉的化学方程式:____ 。
(2)实验室利用如图装置制备KClO和KClO3。
已知:6OH-+3Cl2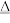 5Cl-+ClO
5Cl-+ClO +3H2O
+3H2O

①盛放浓盐酸的仪器名称是____ ,A中发生反应的离子方程式为____ 。
②B的作用是____ ;C中试管内盛放的试剂为____ 。
③用8.7gMnO2与足量浓盐酸充分反应,生成Cl2在标况下的体积为____ 。
(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为____ 。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是____ 。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。取含次氯酸钠14.9g·L-1的84消毒液1mL,加水稀释至100mL,稀释后的溶液中次氯酸钠的物质的量浓度为___ mol·L-1。
(1)漂白粉是常见的消毒剂,写出工业制取漂白粉的化学方程式:
(2)实验室利用如图装置制备KClO和KClO3。
已知:6OH-+3Cl2
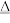 5Cl-+ClO
5Cl-+ClO +3H2O
+3H2O
①盛放浓盐酸的仪器名称是
②B的作用是
③用8.7gMnO2与足量浓盐酸充分反应,生成Cl2在标况下的体积为
(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。取含次氯酸钠14.9g·L-1的84消毒液1mL,加水稀释至100mL,稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次



