名校
解题方法
1 . 我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
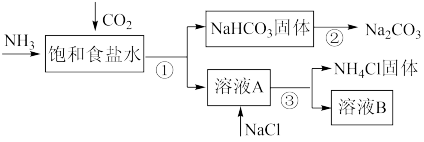
(1)①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(2)根据上图,将化学方程式补充完整: NH3 + CO2 +___________+___________ = NaHCO3↓+ NH4Cl,___________
(3)下列说法中,正确的是___________ (填字母)。
(4)某种市售食用碱是纯碱与小苏打的混合物,可大量应用于食品加工,如:面条、面包、馒头等,某校化学兴趣小组利用如图所示装置进行实验测定此种食用碱中纯碱的质量分数。
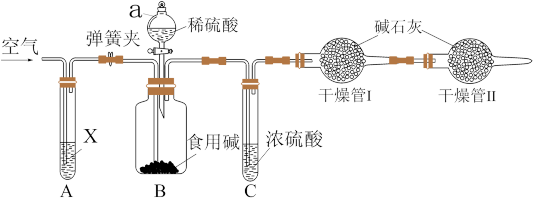
实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
请回答下列问题:
①装置a的仪器名称是___________ ,
②试剂X为NaOH溶液,实验开始前,先打开弹簧夹,通入一段时间空气,其目的为___________ ,实验结束后,需要继续通入一段时间的空气,其目的是将装置内的CO2赶到干燥管中被吸收。
③干燥管II的作用是___________ 。
④有同学认为,表格中三组数据都可以计算该样品中Na2CO3的质量分数,但也有同学认为不能用装置C前后的质量差来计算,其理由是吸收的水蒸气并不全部来自反应生成 ;通过实验数据计算,食用碱中Na2CO3的质量分数为___________ (保留三位有效数字)。

(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上图,将化学方程式补充完整: NH3 + CO2 +___________+___________ = NaHCO3↓+ NH4Cl,
(3)下列说法中,正确的是___________ (填字母)。
| A.碳酸氢钠分解产生的CO2可回收并循环使用 |
| B.NH4Cl副产物可用作氮肥 |
C.溶液B中一定含有Na+、NH 、Cl- 、Cl- |
| D.饱和氯化钠溶液中应该先通二氧化碳再通入氨气 |

实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
| 装置B | 装置C | 干燥管I | |
| 实验前称得的质量/g | 180.0 | 30.0 | 120.4 |
| 实验后称得的质量/g | 174.2 | 31.5 | 124.8 |
①装置a的仪器名称是
②试剂X为NaOH溶液,实验开始前,先打开弹簧夹,通入一段时间空气,其目的为
③干燥管II的作用是
④有同学认为,表格中三组数据都可以计算该样品中Na2CO3的质量分数,但也有同学认为不能用装置C前后的质量差来计算,其理由是吸收的水蒸气并不全部来自反应生成 ;通过实验数据计算,食用碱中Na2CO3的质量分数为
您最近一年使用:0次
解题方法
2 . 海洋是人类未来赖以生存和发展的资源宝库,合理开发和有效利用应得到重视。如从海藻灰中可得到NaI溶液。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有___________ 。
(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
①用CCl4萃取反应后I、II、III、IV 的溶液,萃取后下层CCl4均为无色,取萃取后的上层溶液,用淀粉检验:I、Ⅱ的溶液变蓝色;III的溶液蓝色不明显、Ⅳ的溶液未变蓝。
i.写出实验Ⅰ中反应的离子方程式___________ 。
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:
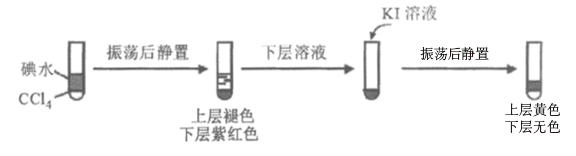
用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是___________ 。
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:
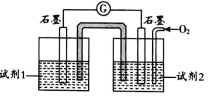
据此分析,试剂1是___________ ;试剂2是 ___________ 。
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为___________ 。
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++ +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。
①该实验达到滴定终点时,现象为___________ 。
②根据滴定有关数据,该NaI溶液中I—含量是___________ g·L-1。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有

(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
| 实验 | 编号 | pH = a | 现象 |
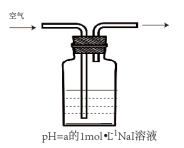 | I | 3 | 4分钟左右,溶液呈黄色 |
| Ⅱ | 7 | 60分钟左右,溶液呈浅黄色 | |
| Ⅲ | 8 | 10小时后,溶液呈很浅的黄色 | |
| Ⅳ | 10 | 10小时后,溶液颜色无明显变化 |
i.写出实验Ⅰ中反应的离子方程式
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:

用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:

据此分析,试剂1是
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++
 +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。①该实验达到滴定终点时,现象为
②根据滴定有关数据,该NaI溶液中I—含量是
您最近一年使用:0次
3 . 某小组为探究Mg与NH4Cl溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
资料:①CH3COONH4溶液呈中性。
②Cl-对该反应几乎无影响。
(1)经检验实验2中刺激性气味气体为NH3,检验方法是____ 。用排水法收集一小试管产生的气体,经检验小试管中气体为H2。
(2)已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有____ ,灰白色固体可能是____ (填化学式)。
(3)甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。用化学用语解释NH4Cl溶液显酸性的原因是_____ 。
(4)乙同学通过实验3证明甲同学的说法不合理 。
①试剂X是_______ 。
②由实验3获取的证据为_______ 。
(5)为进一步探究实验2反应剧烈的原因,进行实验4。
依据上述实验,可以得出Mg能与 反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是
反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是_______ 。
(6)由以上实验可以得出的结论是_______ 。
资料:①CH3COONH4溶液呈中性。
②Cl-对该反应几乎无影响。
| 实验 | 实验试剂 | 实验现象 |
| 1 | 5mL蒸馏水 | 反应缓慢,有少量气泡产生(经检验为H2) |
| 2 | 5mL 1.0 mol/L NH4Cl溶液(pH=4.6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
(2)已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有
(3)甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。用化学用语解释NH4Cl溶液显酸性的原因是
(4)乙同学通过实验3证明甲同学的说法
| 实验 | 实验装置 |
| 3 | 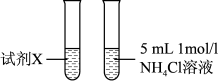 |
②由实验3获取的证据为
(5)为进一步探究实验2反应剧烈的原因,进行实验4。
| 实验 | 实验试剂 | 实验现象 |
| 4 | 5 mL NH4Cl乙醇溶液 | 有无色无味气体产生(经检验为H2) |
 反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是
反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是(6)由以上实验可以得出的结论是
您最近一年使用:0次



