2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷
山西
高三
阶段练习
2017-07-27
445次
整体难度:
适中
考查范围:
认识化学科学、化学实验基础、常见无机物及其应用、物质结构与性质
一、单选题 添加题型下试题
| A.胶体的丁达尔现象 | B.胶体的布朗运动 |
| C.胶体的电泳 | D.渗析 |
【知识点】 分散系
| A.盐酸、漂白粉都是混合物 | B.127I和131I互为同素异形体 |
| C.硫酸铜、二氧化硫都是电解质 | D.分馏、干馏都是物理变化 |
【知识点】 物质的分类
①钠应该密封在煤油中保存;②过氧化钠可以露置在空气中保存;③氯水应该密封在无色试剂瓶中保存;④漂白粉不能露置在空气中保存。
| A.①③ | B.①②③④ | C.①③④ | D.①④ |
A.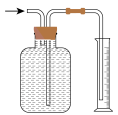 | B.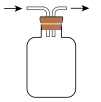 | C. | D. |
【知识点】 仪器使用与实验安全 常见气体的制备与收集解读
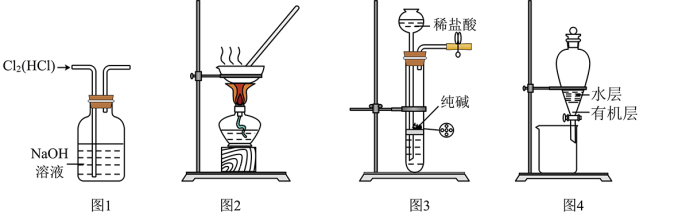
A.用图 所示装置除去 所示装置除去 中含有的少量 中含有的少量 |
B.用图 所示装置蒸干 所示装置蒸干 饱和溶液制备 饱和溶液制备 晶体 晶体 |
C.用图 所示装置制取少量纯净的 所示装置制取少量纯净的 气体 气体 |
D.用图 所示装置分离 所示装置分离 萃取碘水后已分层的有机层和水层 萃取碘水后已分层的有机层和水层 |
| A.除去N2中的少量O2,可通过灼热的Cu网后,收集气体 |
| B.除去Fe(OH)3胶体中混有的Cl- 离子,可用渗析的方法 |
| C.除去乙醇中的少量NaCl,可用蒸馏的方法 |
| D.重结晶、滴定操作都可用于提纯物质 |
【知识点】 化学实验基础
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小 ②二氧化硫和氯气均能使品红溶液褪色 ③二氧化硫能使品红溶液、溴水褪色 ④氨气和碘化氢气体均不能用浓硫酸干燥 ⑤常温下浓硫酸用铁制容器存放、加热条件下浓硫酸能与木炭反应 ⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字 ⑦二氧化碳、二氧化硫使澄清石灰水变浑浊
| A.只有②③④ | B.只有⑤⑦ | C.只有③④⑥⑦ | D.全部 |
| A.CaH2既是氧化剂,又是还原剂 |
| B.H2既是氧化产物,又是还原产物 |
| C.CaH2是还原剂,H2O是氧化剂 |
| D.氧化产物与还原产物的质量比为1∶1 |
| A.NH4+、Na+、S2-、ClO- | B.K +、SO42-、OH-、AlO2- |
| C.K +、Fe3+、Cl-、NO3- | D.Ba2+、Na+、OH-、CO32- |
【知识点】 离子共存
| 选项 | 陈述I | 陈述II | 判断 |
| A | 铝制炊具最好不要盛放酸性或碱性较强的液体食物 | 因为Al和Al2O3既可以与酸反应又可以与碱反应 | I对,Ⅱ对,有 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 因为铝箔对熔化的铝有较强的吸附作用 | I对,II对,有 |
| C | 海啸使水源发生污染可用明矾进行消毒和净化 | 因为明矾水解生成Al(OH)3胶体,具有吸附性 | I对,II错,无 |
| D | 铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 因为铁和铝不能与浓硫酸或浓硝酸反应 | I错,II对,无 |
| A.A | B.B | C.C | D.D |
【知识点】 铝 氧化铝 铝制品日常使用的注意事项解读
| A.鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+=CO2↑+H2O |
| B.四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| C.将氨气通入硫酸溶液中:NH3 + H+ = NH4+ |
| D.向碳酸氢铵溶液中加入足量的NaOH溶液:NH4+ +OH-= NH3·H2O |
【知识点】 离子反应的发生及书写
| 选项 | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 | 试样溶解硝酸钡溶液白色沉淀稀硝酸沉淀不溶 |
| B | 检验某盐是否为铵盐 | 试样加热是否产生能使湿润的红色石蕊试纸变蓝的气体 |
| C | 证明酸性条件下H2O2的氧化性比I2强 | NaI溶液30%H2O2溶液稀硝酸及淀粉溶液变蓝色 |
| D | 除去氯化钠晶体中少量硝酸钾 | 试样加适量水溶解蒸发到剩少量液体趁热过滤洗涤晶体重结晶 |
| A.A | B.B | C.C | D.D |
【知识点】 化学实验基础
A.1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为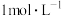 |
B.从1L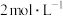 的 的 溶液中取出0.5L,该溶液的浓度为 溶液中取出0.5L,该溶液的浓度为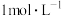 |
C.配制480mL 的 的 溶液,需称量62.5g胆矾 溶液,需称量62.5g胆矾 |
D.中和100mL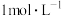 的 的 溶液,需要4g NaOH 溶液,需要4g NaOH |
| A.20g | B.40g | C.58g | D.80g |
【知识点】 氧化还原反应有关计算 硝酸的强氧化性解读
| A.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、Al3+、Cl-、NO3- |
| B.在由水电离出的c(H+)=1×10-12mol·L-1的溶液中:Fe2+、ClO-、Na+、SO42- |
| C.在加入镁粉产生气体的溶液中:SO42-、NO3-、Na+、Fe2+ |
| D.在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
【知识点】 离子共存
| A.一定含有I-,不能含有Cl- | B.可能含有Cl-、NO3-和I- |
| C.可能含有NO3- | D.不含有Fe3+ |
【知识点】 离子共存
| A.124g P4含有的P-P键的个数为6NA |
| B.12g石墨中含有的C-C键的个数为2NA |
| C.12g金刚石中含有的C-C键的个数为1.5NA |
| D.60gSiO2中含Si-O键的个数为2NA |
| A.向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+ OH-=CO2↑+H2O |
| C.向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ |
| D.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
【知识点】 离子反应的发生及书写
| A.白色沉淀是BaSO4和BaSO3 | B.溶液的酸性增强 |
| C.白色沉淀是BaSO4 | D.FeCl3全部被还原为FeCl2 |
| A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在 |
| B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在 |
| C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO42-存在 |
| D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
【知识点】 离子的检验
①向饱和碳酸钠溶液中通入过量CO2②向Fe(OH)3胶体中逐滴滴入过量的H2SO4
③向Ba(NO3)2溶液中通入过量SO2④向石灰水中通入过量CO2
⑤向硅酸钠溶液中滴入过量的盐酸.
| A.①②③ | B.①②⑤ | C.①②③⑤ | D.①③⑤ |
| A.0.2 mol H2O:完全分解转移的电子数为0.4NA |
| B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6NA |
| C.在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4NA |
| D.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2NA |
【知识点】 化学计量
| A.③⑤ | B.①③⑥ | C.仅有⑤ | D.②④ |
【知识点】 离子反应的发生及书写
二、解答题 添加题型下试题

(1)将仪器连接好以后,必须进行的第一步操作是
(2)此实验还必须用到的最重要的仪器是
(3)已知仪器C中装有品红溶液,其作用是
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.酸性高锰酸钾溶液
c.品红溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.碱石灰
g.无水硫酸铜
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:B中
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是
(5)若仪器E在实验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是
(2)实验I中生成沉淀的离子方程式为
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol·L-1 | | | | |
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+ 3NaClO + 4NaOH = 2Na2FeO4+ 3X + 5H2O,则X的化学式
(2)铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
FeS2+
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是
三、填空题 添加题型下试题
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是
(5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的1/8(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2—NH2)形成配离子:


该配离子中含有的化学键类型有
a.配位键
B.极性键
C.离子键
D.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2—NH2)中C原子的杂化方式为
【知识点】 物质结构与性质
试卷分析
试卷题型(共 29题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 分散系 | |
| 2 | 0.64 | 物质的分类 | |
| 3 | 0.64 | 化学实验基础 | |
| 4 | 0.65 | 氯水的性质 漂白粉的变质原因及检验 钠单质的保存与用途 过氧化钠 | |
| 5 | 0.65 | 仪器使用与实验安全 常见气体的制备与收集 | |
| 6 | 0.85 | 氯气与碱溶液反应 铵盐的不稳定性 萃取和分液 | |
| 7 | 0.85 | 原子晶体(旧教材) | |
| 8 | 0.64 | 化学实验基础 | |
| 9 | 0.65 | 硫酸 二氧化硫的漂白性 浓硫酸的吸水性 浓硫酸的强氧化性 | |
| 10 | 0.85 | 氧化还原反应基本概念 氧化还原反应的应用 氧化还原反应在生活、生产中的应用 氧化还原反应的规律 | |
| 11 | 0.64 | 离子共存 | |
| 12 | 0.85 | 铝 氧化铝 铝制品日常使用的注意事项 | |
| 13 | 0.64 | 离子反应的发生及书写 | |
| 14 | 0.64 | 化学实验基础 | |
| 15 | 0.85 | 物质的量浓度计算-溶液配制有关计算 一定物质的量浓度的溶液的配制 配制一定物质的量浓度溶液的综合考查 | |
| 16 | 0.65 | 氧化还原反应有关计算 硝酸的强氧化性 | |
| 17 | 0.64 | 离子共存 | |
| 18 | 0.64 | 离子共存 | |
| 19 | 0.65 | 常见分子晶体的结构 常见原子晶体的结构 | |
| 20 | 0.64 | 离子反应的发生及书写 | |
| 21 | 0.65 | 二氧化硫与其他强氧化剂的反应 铁盐的检验 Fe3+与其他物质氧化性强弱关系 | |
| 22 | 0.85 | 离子的检验 | |
| 23 | 0.65 | 胶体的性质和应用 硅酸钠与酸液反应 | |
| 24 | 0.64 | 化学计量 | |
| 25 | 0.64 | 离子反应的发生及书写 | |
| 二、解答题 | |||
| 26 | 0.4 | 化学实验基础 钠及其化合物 | 实验探究题 |
| 27 | 0.65 | 限定条件下的离子共存 离子反应在化合物组成的分析、鉴定的应用 常见阳离子的检验 常见阴离子的检验 | 无机推断题 |
| 28 | 0.65 | 高铁酸钠 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 三、填空题 | |||
| 29 | 0.15 | 物质结构与性质 | |







