广东省阳东广雅学校2018届高三上学期第一次月考化学试题
广东
高三
阶段练习
2017-10-25
303次
整体难度:
适中
考查范围:
化学与STSE、化学实验基础、认识化学科学、物质结构与性质、常见无机物及其应用、有机化学基础
广东省阳东广雅学校2018届高三上学期第一次月考化学试题
广东
高三
阶段练习
2017-10-25
303次
整体难度:
适中
考查范围:
化学与STSE、化学实验基础、认识化学科学、物质结构与性质、常见无机物及其应用、有机化学基础
一、单选题 添加题型下试题
单选题
|
适中(0.64)
1. 化学与生产、生活、环境等社会实际密切相关。下列叙述错误 的是
| A.减少机动车尾气的排放,可以降低雾霾的发生 |
| B.垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能 |
| C.推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
| D.燃料电池是一种高效、环境友好的发电装置 |
【知识点】 化学与环境保护
您最近一年使用:0次
2016-12-09更新
|
148次组卷
|
3卷引用:2016届广东省揭阳市高三下学期一模理综化学试卷
2. 我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
| A.萃取 | B.渗析 | C.干馏 | D.蒸馏 |
【知识点】 物质的分离、提纯 物质分离、提纯的常见物理方法 蒸馏与分馏解读
您最近一年使用:0次
2020-04-17更新
|
647次组卷
|
47卷引用:山东省泰安市2016-2017学年高一下学期期末考试化学试题
山东省泰安市2016-2017学年高一下学期期末考试化学试题湖北省武汉市部分学校2018届高三9月起点调研考试化学试题山西省运城市康杰中学2017-2018学年高一上学期第一次月考化学试题陕西省西北工业大学附属中学2018届高三第一次月考化学试题广东省阳东广雅学校2018届高三上学期第一次月考化学试题河南省周口市郸城县第一高级中学2017-2018学年高一10月月考化学试题河南省信阳高级中学2017-2018学年高一10月月考化学试题福建省福州市八县(市)协作校2017-2018学年高二上学期期中联考化学(理)试题黑龙江省牡丹江市第一高级中学2017-2018学年高一上学期期中考试化学试题广东省珠海市珠海二中、斗门一中2017-2018学年高一上学期期中联考化学试题江西省金溪一中、余江一中等五市八校2018届高三上学期第一次联考化学试题云南省昆明市第一中学2018届高三第七次月考理综化学试题甘肃省酒泉市敦煌中学2019届高三一诊化学试题山西省汾阳市第二高级中学、文水二中2017-2018学年高一上学期第一次联考测试化学试题山东省济宁市第一中学2019届高三第一学期收心考试化学试题河南省驻马店经济开发区高级中学2019届高三上学期第一次月考化学试题吉林省长春市田家炳实验中学2019届高三上学期第一次调研测试化学试题河南省永城高中2018-2019学年高一上学期第一次月考化学试题【全国百强校】广东省湛江市第一中学2018-2019学年高二上学期第一次大考化学试题云南省梁河县第一中学2018-2019学年高一上学期期中考试化学试题河北省唐山市玉田县2018-2019学年高一上学期期中考试化学试题广东省揭西县河婆中学2018-2019学年上学期高一期中考试化学试题湖北省黄冈市2018-2019学年高一6月月考化学试题吉林省白山市抚松六中2019-2020学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学2019-2020学年高一上学期期中考试化学试题四川省棠湖中学2019-2020学年高一上学期期中考试化学试题山西省忻州市岢岚县中学2019-2020学年高一上学期期中考试化学试题河北省承德第一中学2019-2020学年高一上学期第三次月考化学试题河北省秦皇岛市昌黎县第八中学2019-2020学年高一上学期12月月考化学考试题2019-2020学年高一上学期期末复习《新题速递·化学》12月第1期(考点01-06)湖南省郴州市湘南中学2019-2020学年高一上学期期中考试化学试题河北省武邑中学2019-2020学年高一12月月考化学试题安徽省合肥市六校2019-2020学年高一上学期期末考试化学试题湖北省武汉市新洲区部分学校2019~2020 学年高一上学期期末质量检测化学试题2019-2020学年高一上学期期末复习《新题速递·化学》第1期(考点01-06)(已下线)【南昌新东方】2019 师大附中 高一上第一次月考河北省唐山遵化市2019-2020学年高一上学期期中考试化学试题山东省济南市章丘区第四中学2021届高三上学期第一次教学质量检测(8月)化学试题广东省东莞三校(万江,六中,常平)2019-2020学年高一上学期期中联考化学试题宁夏长庆高级中学2020-2021学年高一上学期期中考试化学试题1广东省湛江市2021届高三下学期3月普通高考测试(一)化学试题(已下线)押山东卷第08题 化学实验常用仪器和基本操作-备战2021年高考化学临考题号押题(山东卷)湖北省蕲春县2020-2021学年高二下学期期中考试化学试题西藏拉萨中学2021-2022学年高一上学期12月考试化学试题重庆市北碚区2019-2020学年高二上学期学业水平适应性考试(12月)化学试题广东省茂名市高州市第一中学2021届高三下学期3月月考化学试题(已下线)第2讲 物质的分离与提纯
单选题
|
适中(0.65)
3. 设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,18gH2O中含有的原子总数为3NA |
| B.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| C.标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA |
| D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
您最近一年使用:0次
2020-10-31更新
|
3012次组卷
|
20卷引用:2014届高考化学二轮专题冲刺第2讲 化学常用计量练习卷
(已下线)2014届高考化学二轮专题冲刺第2讲 化学常用计量练习卷(已下线)2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(已下线)2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(已下线)2014高考名师推荐化学NA与粒子2012年普通高等学校招生全国统一考试化学(江苏卷)2015-2016浙江宁波效实中学高一上期中考试化学试卷2016届西藏自治区拉萨中学高三上学期第四次月考化学试卷2016届辽宁省沈阳东北育才学校高三上第三次模拟化学试卷湖北省荆州中学2016-2017学年高一下学期5月阶段测化学试题广东省阳东广雅学校2018届高三上学期第一次月考化学试题吉林省长春外国语学校2017-2018学年高一下学期期初考试化学试题浙江省东阳中学2018-2019学年高二6月月考化学试题2020届高三高考化学总复习考点强化练习:从实验学化学(已下线)【南昌新东方】2019 进贤一中 高一上第一次月考(已下线)【南昌新东方】15. 莲塘二中 曹永康.吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题(已下线)专题01 阿伏加德罗常数正误判断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题(已下线)微专题03 破解“七陷阱”突破NA-备战2023年高考化学一轮复习考点微专题(已下线)易错点07 阿伏加德罗常数的判断-备战2023年高考化学考试易错题
单选题
|
较易(0.85)
名校
4. 设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.30 g乙烷中所含的极性共价键数为7NA |
| B.标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA |
| C.1 L浓度为1 mol·L-1的 H2O2水溶液中含有的氧原子数为2NA |
| D.MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA |
您最近一年使用:0次
2017-10-23更新
|
182次组卷
|
4卷引用:广东省阳东广雅学校2018届高三上学期第一次月考化学试题
单选题
|
适中(0.65)
真题
名校
5. 设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA |
| B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
【知识点】 阿伏加德罗常数的应用解读
您最近一年使用:0次
2019-01-30更新
|
3073次组卷
|
23卷引用:2012年普通高等学校招生全国统一考试理综化学部分(四川卷)
2012年普通高等学校招生全国统一考试理综化学部分(四川卷)(已下线)2013届山西省忻州一中高三第一次月考化学试卷(已下线)2015届江西师大附中高三年级10月月考化学试卷2015届江苏常州市高三第一次调研试卷化学试卷2016届四川省彭州中学高三9月月考化学试卷2016届甘肃省天水市秦安县第二中学高三上第一次检测考试化学试卷2016届江西省丰城中学课改实验班高三上学期10月月考化学试卷2015-2016学年湖南省双峰一中高一下期中理科化学试卷2017届江西省上高二中高三上第二次月考化学试卷2016-2017学年辽宁省铁岭市清河高级中学高二下学期第一阶段考试化学试卷江西省南昌市第三中学2016-2017学年高一下学期期末考试化学试题广东省阳东广雅学校2018届高三上学期第一次月考化学试题湖南省衡阳县第一中学2018届高三上学期第二次月考化学试题河南省安阳市第三十六中学2018届高三上学期第一次月考化学试题浙江省杭州市学军中学2018届高三选考前适应性练习(2)化学试题安徽省滁州市定远县民族中学2017-2018学年高一下学期期末考试化学试题河南省安阳市第三实验中学2019届高三上学期11月月考化学试题陕西省榆林市第二中学2018-2019学年高二下学期期中考试化学试题江西省奉新县第一中学2021届高三上学期第二次月考化学试题广西梧州市2021届高三3月联考理科综合化学试题山西省晋中市新一双语学校2021-2022学年高三上学期8月月考化学试题(已下线)专题01 阿伏加德罗常数正误判断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)河南省郑州中学2023-2024学年高三上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
6. 取100mL 0.3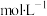 和300mL 0.25
和300mL 0.25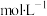 的硫酸注入500mL的容量瓶中,加水稀释至刻度线,则该混合物中
的硫酸注入500mL的容量瓶中,加水稀释至刻度线,则该混合物中 的物质的量浓度为
的物质的量浓度为
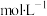 和300mL 0.25
和300mL 0.25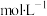 的硫酸注入500mL的容量瓶中,加水稀释至刻度线,则该混合物中
的硫酸注入500mL的容量瓶中,加水稀释至刻度线,则该混合物中 的物质的量浓度为
的物质的量浓度为A.0.21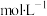 | B.0.26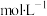 | C.0.42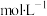 | D.0.56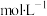 |
【知识点】 物质的量浓度计算-溶液混合的有关计算解读
您最近一年使用:0次
2022-10-11更新
|
510次组卷
|
72卷引用:2012届上海市松江二中高三上学期期中考试化学试卷
(已下线)2012届上海市松江二中高三上学期期中考试化学试卷(已下线)2011-2012学年江西省上高二中高一上学期第二次月考化学试卷(已下线)2011-2012学年内蒙古巴市一中高二下学期期末考试化学试卷(已下线)2012届山东省济宁学院附属中学高三9月月考化学试卷(已下线)2013届吉林省榆树市第一高级中学高三第一次月考化学试卷(已下线)2014-2015学年江西省上高县第二中学高一上学期第一次月考化学试卷2013—2014福建省闽侯一中高三上学期10月月考化学试卷2015-2016学年山东省淄博市淄川一中高一上学期期中测试化学试卷2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷2016届河北省邯郸市广平一中高三上10月月考化学试卷2015-2016学年山东省淄博五中高一下开学收心考试化学试卷2015-2016学年河南省三门峡市陕州一中高二下第三次月考化学试卷2017届陕西省安康市石泉中学高三上学期第一次月考化学试卷2016-2017学年山西省怀仁一中高一上期中化学试卷(已下线)1.2.3 物质的量在化学实验中的应用山西省忻州市第一中学2016-2017学年高一必修一:1.2.3 化学计量在实验中的应用同步练习化学试题2017-2018学年高一人教版必修一:6 物质的量在化学实验中的应用课时训练化学试题广东省阳东广雅学校2018届高三上学期第一次月考化学试题广东省揭阳市惠来县第一中学2017-2018学年高一上学期期中考试化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一12月月考化学试题黑龙江省哈尔滨六中2017-2018学年高一12月月考化学试卷高中化学人教版 必修1 第一章 从实验学化学 2.化学计量在实验中的应用 物质的量浓度(已下线)二轮复习 专题2 化学常用计量 押题专练江苏省泰州中学2017-2018学年高一下学期期初质量检测化学试题(已下线)解密02 化学常用计量——备战2018年高考化学之高频考点解密(已下线)2018年9月11日 《每日一题》人教必修1-溶液中离子浓度之间的关系海南省海口市灵山中学高三上学期第一次测试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期10月摸底考试化学试题山西省应县第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高一上学期期中考试化学试题四川外语学院重庆第二外国语学校2017-2018学年高一上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题2 化学常用计量(押题专练)步步为赢 初高中衔接教材化学暑假作业:第22课时 有关质量分数及物质的量浓度的计算吉林省乾安县第七中学2018-2019学年高二下学期第三次质量检测化学试题陕西省榆林市第二中学2018-2019学年高二下学期期末考试化学试题百所名校联考-从实验学化学黑龙江省大庆市铁人中学2019-2020学年高一10月月考化学试题辽宁省实验中学2019-2020学年高一上学期期中考试化学试题吉林省延边第二中学2019-2020学年高一上学期期中考试化学试题河南省漯河市实验高中2019-2020学年高一上学期期中考试化学试题云南省大理市下关第一中学2019-2020学年高一上学期第二次段考化学试题安徽省萧城一中2020届高三第一次月考化学试题河南省驻马店市正阳县高级中学2019-2020学年高一上学期第三次素质检测化学试题(已下线)上海市建平中学2013届高三第一次模拟化学试题陕西省渭南市大荔县同州中学2019-2020学年高一上学期第一次月考化学试题河北省石家庄市第二中学2018-2019学年高一上学期期末考试化学试题吉林省长春市第一中学2019-2020学年高二下学期阶段测试化学试题吉林省吉林市2019-2020学年高二下学期期末教学质量检测化学试题(已下线)2.2.2 化学反应的计算 练习(1)——《高中新教材同步备课》(苏教版 必修第一册)福建省莆田市仙游县度尾中学2019-2020学年高一上学期期中考试化学试题甘肃省平凉市庄浪县第一中学2021届高三上学期第一次模拟化学试题西藏山南市第二高级中学2021届高三上学期第一次月考化学试题河南省新乡市2020-2021学年高一阶段测试化学试题(已下线)【南昌新东方】5.莲塘一中 曹永康 程秀丽甘肃省武威市第十八中学2021届高三上学期第一次月考化学试题内蒙古乌兰察布市化德一中2020-2021学年高一上学期期中考试化学试题湖南省常德市第一中学2020-2021学年高一上学期第2次月考化学试题江西省赣州市赣县第三中学2020-2021学年高一下学期2月入学考试化学试题(已下线)专题03 溶液——备战2021年高考化学纠错笔记黑龙江省安达市重点高中2020-2021学年高二下学期7月月考化学试题黑龙江省安达市重点高中2020-2021学年高二下学期期末考试化学试题 (已下线)专题2.3.4 配制一定物质的量浓度的溶液(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)第三章 第二节水的电离和溶液的酸碱性(第1课时 水的电离和溶液的酸碱性)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)【苏州新东方】04 十中黑龙江省鸡西市第一中学2021-2022学年高一上学期期中考试化学试题(已下线)第06讲 一定物质的量浓度溶液的配制-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)云南省腾冲市第一中学2021-2022学年高一下学期3月份考试化学试题黑龙江省大庆外国语学校2020-2021学年高二下学期第二次月考化学试题江苏省苏州工业园区星海实验中学2022-2023学年高一上学期第一次月考化学试题湖南省长沙市明德中学2021-2022学年高一上学期12月第三次月考化学试题重庆市杨家坪中学2022-2023学年高一上学期期末质量收官化学自主练习试题第3课时 物质的量浓度
单选题
|
较易(0.85)
名校
7. 下列物质分类正确的是( )
| A.SO2、SiO2、Al2O3均为酸性氧化物 | B.稀豆浆、牛奶、氯化铁溶液均为胶体 |
| C.烧碱、乙醇、四氯化碳均为电解质 | D.福尔马林、水玻璃、氨水均为混合物 |
【知识点】 无机物质的分类 酸、碱、盐、氧化物的概念及其相互联系解读
您最近一年使用:0次
2017-10-23更新
|
136次组卷
|
2卷引用:广东省阳东广雅学校2018届高三上学期第一次月考化学试题
单选题
|
较易(0.85)
真题
名校
8. 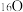 和
和 是氧元素的两种核素,
是氧元素的两种核素, 表示阿伏加德罗常数,下列说法正确的是( )
表示阿伏加德罗常数,下列说法正确的是( )
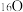 和
和 是氧元素的两种核素,
是氧元素的两种核素, 表示阿伏加德罗常数,下列说法正确的是( )
表示阿伏加德罗常数,下列说法正确的是( )A.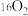 与 与 互为同分异构体 互为同分异构体 |
B.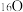 与 与 核外电子排布方式不同 核外电子排布方式不同 |
C.通过化学变化可以实现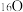 与 与 间的相互转化 间的相互转化 |
D.标准状况下,1.12L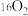 和1.12L 和1.12L 均含有0.1 均含有0.1 个氧原子 个氧原子 |
【知识点】 物理变化与化学变化解读 22.4L/mol适用条件解读 核素
您最近一年使用:0次
2016-12-09更新
|
454次组卷
|
9卷引用:2010年普通高等学校招生全国统一考试理综化学部分(山东卷)
2010年普通高等学校招生全国统一考试理综化学部分(山东卷)2010年高考化学试题分项专题二 化学用语与规律2010年高考化学试题分项专题三 物质的量(已下线)2010年山东省德州一中高一下学期期末考试化学试题(已下线)2010-2011学年内蒙古赤峰二中高一下学期期中考试化学试卷(已下线)2010-2011学年黑龙江省哈尔滨市第六中学高一下学期期末考试化学试卷广东省阳东广雅学校2018届高三上学期第一次月考化学试题福建省福州第一中学2022-2023学年高一上学期期末考试化学试题福建省福清第一中学2023-2024学年高二下学期开门检测化学试题
单选题
|
适中(0.65)
名校
9. 下列说法不正确 的是
| A.Na2O2能与CO2反应,可用作呼吸面具的供氧剂 |
| B.Al2O3熔点高,可用于制作耐高温仪器 |
| C.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| D.SiO2有导电性,可用于制备光导纤维 |
您最近一年使用:0次
2016-12-09更新
|
168次组卷
|
3卷引用:广东省阳东广雅学校2018届高三上学期第一次月考化学试题
单选题
|
较易(0.85)
10. 短周期主族元素W、X、Y、Z的原子序数依次增大。W、Z同族,Y、Z相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半。下列叙述正确的是
| A.金属性:X<Y |
| B.原子半径:Y>Z |
| C.最简单氢化物的热稳定性:Z>W |
| D.Y元素氧化物不溶于X元素最高价氧化物对应水化物的水溶液 |
您最近一年使用:0次
单选题
|
适中(0.65)
11. 汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是


| A.汉黄芩素的分子式为C16H13O5 |
| B.该物质遇FeCl3溶液显色 |
| C.1 mol该物质与溴水反应,最多消耗1 mol Br2 |
| D.1mol该物质与足量H2发生,最多消耗7 mol H2 |
【知识点】 有机官能团的性质及结构 多官能团有机物的结构与性质解读
您最近一年使用:0次
2017-10-23更新
|
162次组卷
|
2卷引用:广东省阳东广雅学校2018届高三上学期第一次月考化学试题
单选题
|
较难(0.4)
名校
12. 我国科研人员以传统中药为原料先制得化合物I,再转化为具有抗癌抑菌活性的化合物Ⅱ,有关转化如图所示,下列有关说法不正确 的是


| A.化合物I分子式为C19H24O5 |
| B.化合物I 和Ⅱ均能与酸性KMnO4溶液和NaOH溶液反应 |
| C.化合物Ⅱ一定条件下能发生取代、消去及加成反应 |
| D.检验化合物Ⅱ中是否含化合物I可用Br2的CCl4溶液 |
【知识点】 有机物的结构特点
您最近一年使用:0次
2016-11-23更新
|
196次组卷
|
8卷引用:2014届江西省南昌市高三3月第一次模拟考试理综化学试卷
(已下线)2014届江西省南昌市高三3月第一次模拟考试理综化学试卷2014-2015学年江西省南昌市八一中学等三校高二下期末化学试卷2016届广东省揭阳市高三下学期一模理综化学试卷2016-2017学年湖南省湘潭一中高二上期中化学卷2016-2017学年四川省成都市第七中学高二下学期半期考试化学试卷广东省阳东广雅学校2018届高三上学期第一次月考化学试题(已下线)黄金30题系列 高二化学(选修5) 小题好拿分【提升版】(已下线)解密15 乙醇、乙酸及基本营养物质——备战2018年高考化学之高频考点解密
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
13. 用98%的浓H2SO4(ρ=1.84 g·cm-3)配制1 mol·L-1稀H2SO4 220 mL。有人设计了以下操作,请填写空白 。
①量取98%的浓H2SO4__________________ mL,应选用___________ mL量筒。
②选取_____________ mL的容量瓶,洗涤,检查是否漏液,将稀释并__________________ 后的H2SO4沿玻璃棒转移到此容量瓶中。
③用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中。
④在小烧杯内稀释浓H2SO4,稀释时用玻璃棒不断搅拌。
⑤向容量瓶中直接加蒸馏水至离刻度线1 cm~2 cm处。
⑥盖上容量瓶塞子,摇匀。
⑦用胶头滴管小心加蒸馏水至刻度线。
⑧将配制好的溶液转入已洗涤但尚未干燥的试剂瓶中贮存备用。
(1)正确的操作步骤是(填序号)_________________________________________ 。
(2)此实验中玻璃棒的作用是____________________________________________ 。
(3)实验操作中有一处错误,该处错误是:____________________________________________
(4)下列操作会使所配溶液浓度偏高、偏低还是无影响。(填“偏高”“偏低”或“无影响”)
Ⅰ.转移硫酸后,小烧杯未洗涤:____________________ 。
Ⅱ. 定容时俯视容量瓶刻度线:____________________ 。
①量取98%的浓H2SO4
②选取
③用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中。
④在小烧杯内稀释浓H2SO4,稀释时用玻璃棒不断搅拌。
⑤向容量瓶中直接加蒸馏水至离刻度线1 cm~2 cm处。
⑥盖上容量瓶塞子,摇匀。
⑦用胶头滴管小心加蒸馏水至刻度线。
⑧将配制好的溶液转入已洗涤但尚未干燥的试剂瓶中贮存备用。
(1)正确的操作步骤是(填序号)
(2)此实验中玻璃棒的作用是
(3)实验操作中有一处错误,该处错误是:
(4)下列操作会使所配溶液浓度偏高、偏低还是无影响。(填“偏高”“偏低”或“无影响”)
Ⅰ.转移硫酸后,小烧杯未洗涤:
Ⅱ. 定容时俯视容量瓶刻度线:
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
较易(0.85)
14. 黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。(M(FeS2)=120g/mol)
已知:SO2 + Fe3+ + H2O ——SO42- +Fe2+ + H+
Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O
(1)将此方程式配平:_______________________________________________________________ H+
(2)样品中FeS2的质量分数是(假设杂质不参加反应)________________ 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________ L,制得98%的硫酸 质量为__________ t 。
已知:SO2 + Fe3+ + H2O ——SO42- +Fe2+ + H+
Cr2O7 2-+ 6 Fe2+ + 14 H+ ==== 2 Cr3+ + 6 Fe3+ + 7 H2O
(1)将此方程式配平:
(2)样品中FeS2的质量分数是(假设杂质不参加反应)
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
名校
15. 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
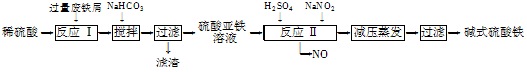
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为______ 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的______ (填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______ 。
(3)反应Ⅱ的离子方程式为______ 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作______ 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为______ 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为______ 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为______ (填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为
(2)加入少量NaHCO3的目的是调节pH,使溶液中的
(3)反应Ⅱ的离子方程式为
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
您最近一年使用:0次
2016-12-09更新
|
341次组卷
|
3卷引用:广东省阳东广雅学校2018届高三上学期第一次月考化学试题
解答题-有机推断题
|
适中(0.65)
真题
16. 某课题组以苯为主要原料,采用以下路线合成利胆药—柳胺酚。
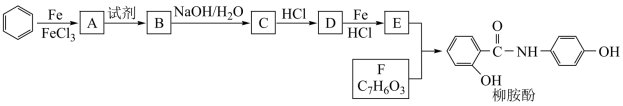
已知: 。请回答下列问题:
。请回答下列问题:
(1)对于柳胺酚,下列说法正确的是___________ 。
A.1 mol柳胺酚最多可以和2 molNaOH反应B.不发生硝化反应
C.可发生水解反应D.可与溴发生取代反应
(2)写出A→B反应所需的试剂___________ 。
(3)写出B→C的化学方程式___________ 。
(4)写出化合物F的结构简式___________ 。
(5)写出同时符合下列条件的F的同分异构体的结构简式___________ (写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应。
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下实例流程图:___________
CH3CHO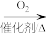 CH3COOH
CH3COOH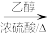 CH3COOCH2CH3
CH3COOCH2CH3

已知:
 。请回答下列问题:
。请回答下列问题:(1)对于柳胺酚,下列说法正确的是
A.1 mol柳胺酚最多可以和2 molNaOH反应B.不发生硝化反应
C.可发生水解反应D.可与溴发生取代反应
(2)写出A→B反应所需的试剂
(3)写出B→C的化学方程式
(4)写出化合物F的结构简式
(5)写出同时符合下列条件的F的同分异构体的结构简式
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应。
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下实例流程图:
CH3CHO
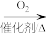 CH3COOH
CH3COOH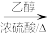 CH3COOCH2CH3
CH3COOCH2CH3
您最近一年使用:0次
2016-12-09更新
|
1206次组卷
|
8卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷)(已下线)2014届高考化学二轮复习江苏专用 高考模拟演练2练习卷(已下线)2014届高考化学二轮复习四川配套训练 第11讲有机化学基础练习卷2016届四川省德阳市香港马会第五中学高三上学期10月月考理综化学试卷12016届四川省德阳市香港马会第五中学高三上学期10月月考理综化学试卷22016届河北省张家口市四校高三上学期联考化学试卷广东省阳东广雅学校2018届高三上学期第一次月考化学试题(已下线)专题23.有机合成与推断-十年(2012-2021)高考化学真题分项汇编(浙江专用)
试卷分析
整体难度:适中
考查范围:化学与STSE、化学实验基础、认识化学科学、物质结构与性质、常见无机物及其应用、有机化学基础
试卷题型(共 16题)
题型
数量
单选题
12
解答题
3
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.64 | 化学与环境保护 | |
| 2 | 0.85 | 物质的分离、提纯 物质分离、提纯的常见物理方法 蒸馏与分馏 | |
| 3 | 0.65 | 阿伏加德罗常数的求算 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 4 | 0.85 | 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 | |
| 5 | 0.65 | 阿伏加德罗常数的应用 | |
| 6 | 0.65 | 物质的量浓度计算-溶液混合的有关计算 | |
| 7 | 0.85 | 无机物质的分类 酸、碱、盐、氧化物的概念及其相互联系 | |
| 8 | 0.85 | 物理变化与化学变化 22.4L/mol适用条件 核素 | |
| 9 | 0.65 | 二氧化硅的用途 过氧化钠的物理性质、组成、结构及用途 氧化铝的物理性质与用途 明矾的净水作用及原理 | |
| 10 | 0.85 | 根据物质性质进行元素种类推断 结合物质计算的元素周期律、元素周期表相关推断 | |
| 11 | 0.65 | 有机官能团的性质及结构 多官能团有机物的结构与性质 | |
| 12 | 0.4 | 有机物的结构特点 | |
| 二、解答题 | |||
| 13 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 15 | 0.4 | 有关铁及其化合物转化的流程题型 Fe2+的鉴别及其应用 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 16 | 0.65 | 有机反应类型 有机物的合成 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |
| 三、填空题 | |||
| 14 | 0.85 | 氧化还原反应方程式的配平 基于氧化还原反应守恒规律的计算 中和滴定 探究物质组成或测量物质的含量 | |



