湖南省长郡中学2018-2019学年高二下学期期末考试化学试题
湖南
高二
期末
2019-09-03
505次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、有机化学基础、化学反应原理、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
| A.人面鱼纹彩陶盆——无机非金属材料 | B.“马踏飞燕”铜奔马——金属材料 |
| C.宇航员的航天服——有机高分子材料 | D.光导纤维——复合材料 |
| A.固体氯化钾 | B.作电极的碳棒 |
| C.气态硝酸 | D.液态氯化氢 |
【知识点】 电解质与非电解质 非电解质、电解质物质类别判断解读
| A.11.2 L 甲烷和乙烯的混合物中含氢原子数目等于2NA |
| B.含NA个 CO32-的 Na2CO3溶液中,Na+数目大于2NA |
| C.密闭容器中,2 molSO2和足量 O2充分反应,产物的分子数小于2NA |
| D.4.0 g CO2气体中含电子数目等于2NA |
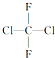 ,下列有关叙述正确的是( )
,下列有关叙述正确的是( )| A.它有两种同分异构体 |
| B.它是平面分子 |
| C.它只有一种结构 |
| D.它有4种同分异构体 |
【知识点】 甲烷的组成与结构
| A.Al→Al2O3→Al(OH)3→AlCl3 | B.Na→NaOH→Na2CO3→NaCl |
| C.Mg→MgCl2→Mg(OH)2→MgSO4 | D.Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
| A.浓硫酸具有强氧化性,但SO2气体可以用浓硫酸干燥 |
| B.常温下,实验室可以用稀硝酸与铜反应制取NO气体 |
| C.从海水中提取溴的过程中常鼓入热空气,其目的是氧化Br— |
| D.SiO2不仅能与氢氧化钠溶液反应.也能与氢氟酸反应 |
A.H2O+ H2O H3O++OH- H3O++OH- |
B.CO2+H2O H2CO3 H2CO3 |
C.HCO3-+OH- H2O+CO32- H2O+CO32- |
D.CO32-+ H2O HCO3- +OH- HCO3- +OH- |
【知识点】 弱电解质的电离方程式解读 水解的离子方程式书写解读
 )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X( )与另一原料Y反应制得,同时生成甲醇。下列说法
)与另一原料Y反应制得,同时生成甲醇。下列说法| A.Y的分子结构中有2个酚羟基 | B.Y的分子式为C15H18O2 |
| C.X的核磁共振氢谱有1个吸收峰 | D.X、Y生成聚碳酸酯发生的是缩聚反应 |
【知识点】 核磁共振氢谱解读 有机官能团的性质及结构 酚类的化学性质 缩聚反应
| A.0.1mol▪L-1NH3▪H2O能使无色酚酞试液变红色 |
| B.0.1mol▪L-1NH4Cl的pH小于7 |
| C.0.1 molL-1 NaOH溶液的导电能力比0.1 molL-1氨水的导电能力强 |
| D.0.1mol▪L-1NH3▪H2O的pH小于13 |
【知识点】 弱电解质在水溶液中的电离平衡解读 盐类水解的原理解读
| A.在使用过程中,电池负极区溶液的pH增大 |
| B.在使用过程中,电子由Ag2O经外电路流向Zn极 |
| C.Zn是负极,Ag2O是正极 |
| D.Zn极发生还原反应,Ag2O极发生氧化反应 |
| A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—) |
| B.c(K+)+ c(S2—) = 0.3mol/L |
| C.c(K+)=c(S2—)+c(HS—)+c(H2S) |
| D.c(OH-)=c(H+)+c(HS—)+2c(H2S) |
 zC,平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是
zC,平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是| A.x+y<z | B.平衡向正反应方向移动 |
| C.B的转化率降低了 | D.C的体积分数增大了 |
【知识点】 浓度对化学平衡移动的影响解读 压强对化学平衡移动的影响解读
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液 | 溶液变为红色 | 样品已被氧化 |
| B | 向酸性KMnO4溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有氧化性 |
| C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大量共存 |
| D | 向1mL 0.1mol•L-1 Na2S溶液中滴入2mL 0.1mol•L-1 ZnSO4溶液,再加入2mL 0.1mol•L-1 CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
| A.A | B.B | C.C | D.D |
【知识点】 Fe2+的鉴别及其应用解读 沉淀转化解读 化学实验方案的设计与评价
| 元素 | 元素的相关信息 |
| M | 最高正价与最低负价的绝对值之和等于2 |
| W | 原子的M电子层上有3个电子 |
| X | 在短周期元素中,其原子半径最大 |
| Y | 最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成Y的单质和H2O |
| Z | 最高价氧化物的水化物与气态氢化物反应生成盐 |
| A.W、Y、Z的简单离子半径依次增大 |
| B.M与Y、Z分别形成的化合物均属于只含有极性键的共价化合物 |
| C.W与M、Y分别形成的化合物都能与水反应,且有气体生成 |
| D.常温下.X、Y、Z的最高价氧化物对应的水化物的浓溶液都能与单质W持续反应 |
| A.NaHSO4溶液中加入Ba(OH)2溶液至沉淀完全:SO42﹣+ H++ Ba2++ OH﹣═ BaSO4↓+ H2O |
| B.NaHCO3溶液中加入过量石灰水:2HCO3﹣+ Ca2++ 2OH﹣═ CaCO3↓ + 2H2O + CO32﹣ |
| C.NaAlO2溶液中通入少量CO2:AlO2﹣+ CO2 + 2H2O ═ Al(OH)3↓ + HCO3﹣ |
| D.Na2CO3溶液与醋酸溶液混合:2H+ + CO32﹣═ CO2↑ +H2O |
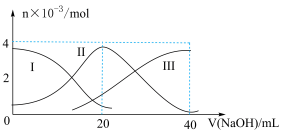
| A.当V(NaOH)=20 mL时.溶液中各离子浓度的大小关系为c(Na+)>c(HA—)>c(H+)>c(A2一)>c(OH—) |
| B.等体积、等物质的量浓度的NaOH溶液与H2 A溶液混合后,其溶液中水的电离程度比纯水中的大 |
| C.NaHA溶液中:c(OH—)+2c(A2—) =c(H+) +c(H2A ) |
| D.将Na2A溶液加水稀释.溶液中所有离子的浓度都减小.但部分离子的物质的量增加 |
二、解答题 添加题型下试题
(1)用下图装置制备纯净的CO2.

①丙装置的名称是
②若CO2中混有HCl,则HCl与Na2O2发生反应的化学方程式为
(2)按下图所示装置进行实验(夹持装置略)。
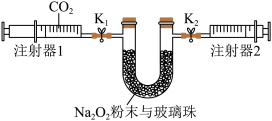
①先组装仪器.然后
②打开止水夹K1、K2,向右推动注射器1的活塞。可观察到的现象是
③实验过程中.需缓慢推入CO2,其目的是
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体的体积为65 mL。则CO2的转化率是
【知识点】 过氧化钠和二氧化碳反应解读 物质含量的测定 物质性质的探究解读
反应①:4NH3 (g)+6NO(g)
 5N2(g)+6H2O(l) ∆H1=-1 807. 0 kJ·mol—1,
5N2(g)+6H2O(l) ∆H1=-1 807. 0 kJ·mol—1,反应②:4NH3(g)+6NO2(g)
 5N2(g)+3O2(g)+6H2O(l) ∆H2=?
5N2(g)+3O2(g)+6H2O(l) ∆H2=?反应③:2NO(g)+O2(g)
 2NO2(g) ∆H3=-113.0kJ·mol一1
2NO2(g) ∆H3=-113.0kJ·mol一1(1)反应②的∆H2==
(2)为探究温度及不同催化剂对反应①的影响.分别在不同温度、不同催化剂下.保持其他初始条件不变重复实验.在相同时间内测得N2浓度的变化情况如下图所示。
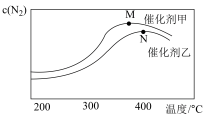
①反应①的平衡常数的表达式K=
②N点后N2浓度减小的原因可能是
(3)某温度下,在1 L恒容密闭容器中初始投入4 mol NH3和6 mol NO发生反应①.当气体总物质的量为7.5mol时反应达到平衡.则NH3的转化率为

已知生成氢氧化物沉淀的pH如下表所示:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
请回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(2)向溶液1中加入双氧水时.发生反应的离子方程式是
(3)向滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生反应的离子方程式是
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,请完成该反应的离子方程式:5Mn2++2ClO3—+
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是
②若在上述MnO2溶液中加入一定量的Mn(NO3 )2粉末.则无Cl2产生.其原因是

已知:a、
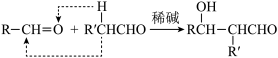 ;
;b、

请回答下列问题:
(1)反应①所需试剂、条件分别是
(2)②的反应类型是
(3)G的结构简式为
(4)化合物W的相对分子质量比化合物C大14。且满足下列条件.W的可能结构有
①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
其中核磁共振氢谱显示有5种不同化学环境的氢.且峰面积比为2:2:2:1:1的结构简式为
(5)设计用甲苯和乙醛为原料制备
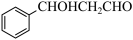 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:A B……
B…… 目标产物)
目标产物) 试卷分析
试卷题型(共 20题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 二氧化硅的用途 金属材料 高分子材料 复合材料 | |
| 2 | 0.85 | 电解质与非电解质 非电解质、电解质物质类别判断 | |
| 3 | 0.65 | 阿伏加德罗常数的求算 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 4 | 0.65 | 甲烷的组成与结构 | |
| 5 | 0.94 | 物质的转化 碳酸钠与碳酸氢钠的相互转化 铝三角转化 与“铁三角”有关的推断 | |
| 6 | 0.65 | 硝酸的强氧化性 浓硫酸的强氧化性 二氧化硅的化学性质 | |
| 7 | 0.65 | 弱电解质的电离方程式 水解的离子方程式书写 | |
| 8 | 0.65 | 核磁共振氢谱 有机官能团的性质及结构 酚类的化学性质 缩聚反应 | |
| 9 | 0.65 | 弱电解质在水溶液中的电离平衡 盐类水解的原理 | |
| 10 | 0.65 | 原电池原理理解 原电池正负极判断 原电池电极反应式书写 锌银纽扣电池 | |
| 11 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 12 | 0.65 | 浓度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 13 | 0.65 | Fe2+的鉴别及其应用 沉淀转化 化学实验方案的设计与评价 | |
| 14 | 0.65 | 元素周期表提供的元素信息 根据原子结构进行元素种类推断 | |
| 15 | 0.4 | 离子反应的发生条件 离子方程式的书写 离子方程式的正误判断 偏铝酸钠与二氧化碳的反应 | |
| 16 | 0.65 | 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 17 | 0.65 | 过氧化钠和二氧化碳反应 物质含量的测定 物质性质的探究 | 实验探究题 |
| 18 | 0.65 | 盖斯定律及其有关计算 化学平衡的有关计算 化学平衡常数的概念及表达方式 | 原理综合题 |
| 19 | 0.65 | 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 20 | 0.65 | 同分异构体的数目的确定 逆合成分析法 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |



