江苏省常州市第一中学2019-2020学年高一上学期期中考试化学试题
江苏
高一
期中
2019-11-29
475次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学、化学实验基础、常见无机物及其应用
一、单选题 添加题型下试题
| A.发现了电子 |
| B.根据a粒子散射实验提出了带核的原子结构模型 |
| C.引入量子学说 |
| D.提出较为系统的化学原子学说 |
【知识点】 研究物质结构的历程及意义解读
| A.75%的酒精溶液 |
| B.硝酸钾 |
| C.Al(OH)3胶体 |
| D.牛奶 |
| A.萃取 | B.沉淀 | C.蒸馏 | D.过滤 |
【知识点】 物质分离、提纯的常见物理方法 萃取和分液解读
| A.Zn+H2SO4=ZnSO4+H2↑ | B.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
C.S+O2 SO2 SO2 | D.CH4+2O2 CO2+2H2O CO2+2H2O |
| A.①② | B.①③ | C.②③ | D.②④ |
【知识点】 决定物质体积大小的微观因素解读
| A.131 |
| B.53 |
| C.78 |
| D.25 |
【知识点】 原子中相关数值及其之间的相互关系解读
| A.①③⑦ | B.②⑥⑦ | C.①④⑧ | D.④⑥⑧ |

| A.提纯含NaCl时氢氧化铁胶体用装置① |
| B.分离碘的四氯化碳溶液用② |
| C.分离NaCl的酒精溶液用装置③ |
| D.除去Cl2中的HCl气体用装置④ |
| A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100nm之间 |
| B.光线透过胶体时,胶体中可发生丁达尔效应 |
| C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
| D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
 0.5
0.5
 溶液中所含的
溶液中所含的 物质的量浓度相同的是
物质的量浓度相同的是A.100 0.5 0.5  溶液 溶液 | B.200 0.25 0.25  溶液 溶液 |
C.50 1 1  溶液 溶液 | D.25 0.5 0.5  溶液 溶液 |
| A.标准状况下44.8L氨气 | B.66g CO2 |
| C.标准状况下90mL水 | D.3.01×1023个氢分子 |
【知识点】 物质的量及单位——摩尔 物质的量有关计算
| A.标况下,22.4L的Cl2与足量水反应中电子转移了2NA |
| B.0.1mol/LK2SO4溶液中含有0.2NA个阳离子 |
| C.常温常压下,22. 4LO2气体的分子数小于NA |
| D.20g D2O所含的中子数为9NA |
| 编组 | 强电解质 | 弱电解质 | 非电解质 |
| A | 氯化钠 | 水 | 氯气 |
| B | 硫酸 | 碳酸钙 | 四氯化碳 |
| C | 氯化银 | HD | 蔗糖 |
| D | 氢氧化钡 | 次氯酸 | 乙醇 |
| A.A | B.B | C.C | D.D |
【知识点】 分类方法的应用解读 非电解质、电解质物质类别判断解读
| A.在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀硝酸不溶解:原未知试液中一定含有SO42﹣ |
| B.某未知气体在空气中燃烧,其产物能使无水CuSO4变蓝色:原气体一定是H2 |
| C.在某未知试液中滴加盐酸产生无色气体,将该气体通入足量澄清石灰水中得白色沉淀:原未知试液中一定含有CO32﹣ |
| D.在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体:原未知试液中一定含有NH4+ |
A.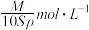 | B.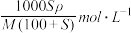 |
C.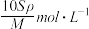 | D. |
| A.H |
| B.Mg |
| C.Fe |
| D.Cu |
【知识点】 化学方程式计算中物质的量的运用解读 氧化还原反应有关计算
| A.Cl—→Cl2 |
| B.KMnO4→MnO2 |
| C.CuO→Cu |
| D.CO→CO2 |
【知识点】 氧化还原反应基本概念 氧化还原反应的规律解读
| A.7:4 | B.7:3 | C.7:2 | D.7:1 |
【知识点】 氧化还原反应有关计算 与氧化剂、还原剂有关的计算解读
| A.实验室保存溴时,常在保存液溴的试剂瓶中加入少量水来防止溴挥发 |
| B.盛放溴水的试剂瓶不能用橡胶塞 |
| C.新制氯水应密封保存在棕色试剂瓶中 |
| D.取碘水于试管中,加入CCl4,振荡后静置,溶液分层,上层呈紫红色 |
【知识点】 溴、碘的性质
二、多选题 添加题型下试题
| A.在与水的反应中,IBr既不是氧化剂又不是还原剂 |
| B.在与水的反应中,IBr既是氧化剂又是还原剂 |
| C.在很多反应中,IBr是强氧化剂 |
| D.IBr跟NaOH稀溶液反应生成NaI、NaBrO和H2O |
三、单选题 添加题型下试题
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.08mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是
| A.K+一定存在 |
| B.100mL溶液中含0.01mol CO32- |
| C.Cl-一定存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |
| A.质量 | B.密度 | C.碳原子数 | D.原子总数 |
【知识点】 阿伏加德罗定律 阿伏加德罗定律及其推论解读
A.(CN)2 + H2O HCN + HCNO HCN + HCNO |
B.(SCN)2 + 2Cu  2CuSCN 2CuSCN |
| C.(OCN)2 + 2NaOH ="==" NaOCN + NaOCNO + H2O |
D.MnO2 + 4HSCN(浓) (SCN)2 + Mn(SCN)2 + 2H2O (SCN)2 + Mn(SCN)2 + 2H2O |
 溶液的棉花球,先给钠预热:到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟,以下叙述
溶液的棉花球,先给钠预热:到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟,以下叙述
| A.反应生成的大量白烟是氯化钠晶体 |
B.浸有 溶液的棉球用于吸收未反应的氯气,以免污染空气 溶液的棉球用于吸收未反应的氯气,以免污染空气 |
| C.用淀粉碘化钾溶液滴在管外的棉球,可以判断氯气是否被完全吸收 |
| D.钠着火燃烧产生苍白色火焰 |
四、填空题 添加题型下试题
(2)工业上可用浓氨水检查氯气管道是否漏气。若有Cl2漏出,与浓氨水接触会有白烟生成,同时产生一种无毒、无可燃性、不污染大气的气体。有关的化学方程式是
(3)铁酸钠(Na2FeO4)是水处理过程中一种新型的净水型,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。
①配平制取铁酸钠的化学方程式:
②用单线桥法标出反应中电子转移的方向和数目
【知识点】 氧化还原反应方程式的配平解读 氯气
五、解答题 添加题型下试题
A.100mL量筒B.托盘天平C.玻璃棒D.50mL容量瓶
E.10mL量筒F.胶头滴管G.50mL烧杯H.100mL容量瓶
(1)需量取浓硫酸的体积为
(2)实验时选用的仪器有
(3)配制过程中,下列情况会使配制结果偏高的是
①定容时俯视刻度线观察液面
②容量瓶使 用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④量取浓硫酸时仰视量筒刻度
⑤移液时未洗涤烧杯和玻璃棒
(4)在容量规使用方法中,下列操作不正确的是
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶
D.将准确量取的18.4mol/L的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E. 定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀

(1)实验室制备氯气的反应原理是
(2)若有87gMnO2参加反应,则被氧化的氯化氢的物质的量为
(3)乙同学认为图甲装置制备的氯气不纯净,其中混有HCl气体和水蒸气,对装置进行了如图乙改进。你认为合理吗?
(4)将图甲装置合理改装后制取并收集一瓶氯气,将灼热的铁丝插到充满氯气的集气瓶中,看到铁丝在氯气中继续燃烧,在集气瓶内充满棕色的烟,烟的成分为反应方程式为
(5)另收集一瓶氯气并在集气瓶中加入水,观察到液体为浅黄绿色,有此现象的原因是
Na2CO3溶液
AgNO3溶液
KI溶液
(6)若实验中有少量的氯气散发到空气中,试设计方案将其检测出

(1)已知步骤①反应器中发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,反应器中发生的化学方程式为6I2+11KClO3+3H2O→6KH(IO3)2+5KCl+3Cl2↑。参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
操作③得到碘酸钾晶体,方法是
(2)已知: KIO3+ 5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32—=2I—+S4O62—
检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有
(3)检验加碘食盐中碘的含量,学生乙设计的实验步骤如下:
①准确称取wg食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
③以淀粉为指示剂,逐滴加入2.0╳10—3mol/L的Na2S2O310.0mL,恰好反应完全。
则加碘食盐样品中的碘元素含量是
(4)学生丙又对纯净的NaCl进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取lg纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL 0.1 mol·L-1K溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴I mol·L-1的H2SO4,振荡. | 溶液变蓝色 |
请推测实验中产生蓝色现象的可能原因
(5)根据学生丙的实验结果,学生乙测得的食盐中碘元素的含量可能
试卷分析
试卷题型(共 29题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 研究物质结构的历程及意义 | |
| 2 | 0.85 | 化学物质的分类方法 分类方法的应用 | |
| 3 | 0.85 | 物质分离、提纯的常见物理方法 萃取和分液 | |
| 4 | 0.85 | 氧化还原反应基本概念 四种基本反应类型与氧化还原反应的关系 | |
| 5 | 0.94 | 决定物质体积大小的微观因素 | |
| 6 | 0.85 | 原子中相关数值及其之间的相互关系 | |
| 7 | 0.94 | 仪器使用与实验安全 常用仪器及使用 | |
| 8 | 0.85 | 物质的分离、提纯 物质分离、提纯的常见物理方法 物质分离、提纯的常见化学方法 萃取和分液 | |
| 9 | 0.94 | 胶体 分散系概念及其分类 胶体的性质和应用 | |
| 10 | 0.85 | 物质的量浓度的基础计算 物质的量浓度与溶质成分有关的计算 | |
| 11 | 0.85 | 物质的量及单位——摩尔 物质的量有关计算 | |
| 12 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 13 | 0.85 | 分类方法的应用 非电解质、电解质物质类别判断 | |
| 14 | 0.65 | 铵根离子的检验 硫酸根离子的检验 离子的检验 常见阴离子的检验 | |
| 15 | 0.65 | 依据物质的量浓度公式的基础计算 物质的量浓度计算-溶液配制有关计算 | |
| 16 | 0.65 | 化学方程式计算中物质的量的运用 氧化还原反应有关计算 | |
| 17 | 0.65 | 氧化还原反应基本概念 氧化还原反应的规律 | |
| 18 | 0.4 | 氧化还原反应有关计算 与氧化剂、还原剂有关的计算 | |
| 19 | 0.85 | 溴、碘的性质 | |
| 20 | 0.65 | 氯气与水的反应 氯水的性质 | |
| 22 | 0.65 | 离子反应的实际应用 离子反应在化合物组成的分析、鉴定的应用 离子的检验 常见阴离子的检验 | |
| 23 | 0.65 | 阿伏加德罗定律 阿伏加德罗定律及其推论 | |
| 24 | 0.85 | 氧化还原反应的规律 拟卤素 | |
| 25 | 0.65 | 氯气与金属单质的反应 氯气与还原性化合物的反应 氯气与碱溶液反应 钠与氧气等非金属的反应 | |
| 二、多选题 | |||
| 21 | 0.85 | 氧化还原反应的应用 氧化还原反应的规律 其他含卤化合物 | |
| 三、填空题 | |||
| 26 | 0.65 | 氧化还原反应方程式的配平 氯气 | |
| 四、解答题 | |||
| 27 | 0.65 | 一定物质的量浓度的溶液的配制 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 | 实验探究题 |
| 28 | 0.4 | 氯气的制法 氯气的实验室制法 化学实验探究 | 实验探究题 |
| 29 | 0.4 | 其他含卤化合物 常见无机物的制备 物质含量的测定 | 工业流程题 |



