工业废水中的氨氮(以 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。
(1)微生物法:酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。
① 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
② 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为_______ 。
(2)次氯酸钠氧化法:向氨氮废水中加入 ,氨氮转化为
,氨氮转化为 而除去。
而除去。
① 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
②一定 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。 :
: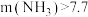 时,总氮的去除率随
时,总氮的去除率随 :
: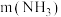 的增大不升反降的原因是
的增大不升反降的原因是_______ 。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,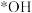 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。_______ 。
②其它条件不变调节废水的 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是_______ 。 晶体进行纯度测定:
晶体进行纯度测定:
a.称取 样品,将其配成
样品,将其配成 溶液。
溶液。
b.先向锥形瓶内加入一定浓度的 溶液,加热至
溶液,加热至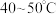 。冷却后再向其中加入
。冷却后再向其中加入
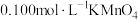 溶液,充分混合。
溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液 。
。
(NaNO2与 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)
通过计算,该样品中 的质量分数是
的质量分数是_______ 。(写出计算过程)
 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。(1)微生物法:酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。①
 转化为
转化为 的离子方程式为
的离子方程式为②
 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为(2)次氯酸钠氧化法:向氨氮废水中加入
 ,氨氮转化为
,氨氮转化为 而除去。
而除去。①
 氧化
氧化 的离子方程式为
的离子方程式为②一定
 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。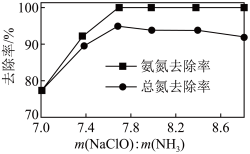
 :
: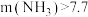 时,总氮的去除率随
时,总氮的去除率随 :
: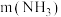 的增大不升反降的原因是
的增大不升反降的原因是(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,
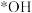 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。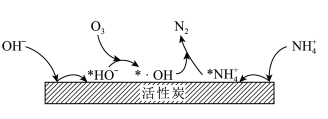
②其它条件不变调节废水的
 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是
 晶体进行纯度测定:
晶体进行纯度测定:a.称取
 样品,将其配成
样品,将其配成 溶液。
溶液。b.先向锥形瓶内加入一定浓度的
 溶液,加热至
溶液,加热至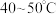 。冷却后再向其中加入
。冷却后再向其中加入
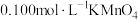 溶液,充分混合。
溶液,充分混合。c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液
 。
。(NaNO2与
 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)通过计算,该样品中
 的质量分数是
的质量分数是
更新时间:2024-04-26 09:06:54
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】氮氧化物和硫氧化物是造成大气污染的主要原因之一,消除氮氧化物有多种方法。回答下列问题:
(1)利用石灰乳和硝酸工业的尾气(含NO、 )反应,既能净化尾气,又能获得应用广泛的
)反应,既能净化尾气,又能获得应用广泛的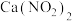 ,其部分工艺流程如图所示:
,其部分工艺流程如图所示:
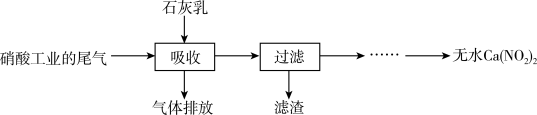
①上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是___________ ;滤渣可循环使用,滤渣的主要成分是___________ (填化学式)。
②生产中溶液需保持弱碱性。在酸性溶液中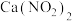 会发生分解,其还原产物为NO,氧化产物为一种强酸,则该反应的离子方程式为
会发生分解,其还原产物为NO,氧化产物为一种强酸,则该反应的离子方程式为___________ 。
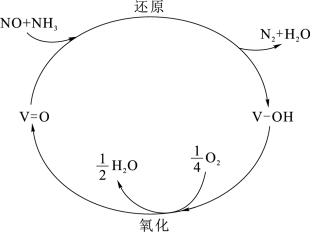
(2) 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
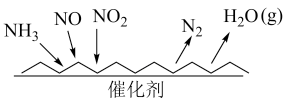
①由图可知SCR技术中的氧化剂为___________ ,还原剂为___________ 。当 与
与 反应时,消耗氧化剂1.5mol,转移电子的物质的量为
反应时,消耗氧化剂1.5mol,转移电子的物质的量为___________ 。
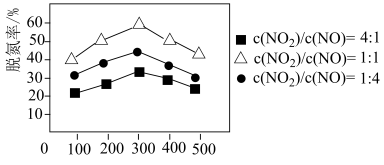
②用Fe做催化剂时,在氨气足量的情况下,不同 对应的脱氮率如图所示,脱氮效果最佳的
对应的脱氮率如图所示,脱氮效果最佳的
___________ 。
(3)SCR的另一种脱硝技术的反应原理如图所示,写出该反应在催化剂作用下的化学方程式:___________ 。
(1)利用石灰乳和硝酸工业的尾气(含NO、
 )反应,既能净化尾气,又能获得应用广泛的
)反应,既能净化尾气,又能获得应用广泛的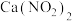 ,其部分工艺流程如图所示:
,其部分工艺流程如图所示:
①上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是
②生产中溶液需保持弱碱性。在酸性溶液中
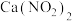 会发生分解,其还原产物为NO,氧化产物为一种强酸,则该反应的离子方程式为
会发生分解,其还原产物为NO,氧化产物为一种强酸,则该反应的离子方程式为(2)
 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
①由图可知SCR技术中的氧化剂为
 与
与 反应时,消耗氧化剂1.5mol,转移电子的物质的量为
反应时,消耗氧化剂1.5mol,转移电子的物质的量为②用Fe做催化剂时,在氨气足量的情况下,不同
 对应的脱氮率如图所示,脱氮效果最佳的
对应的脱氮率如图所示,脱氮效果最佳的

(3)SCR的另一种脱硝技术的反应原理如图所示,写出该反应在催化剂作用下的化学方程式:

您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐2】铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是__________ (填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为_____________________ 。
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:
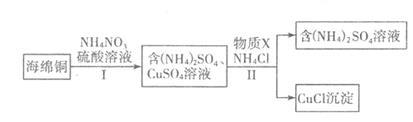
①步骤I中反应温度不宜过高的原因是_______________ ,当0.5 mol NH4NO3参加反应时,反应中有4 mol电子发生转移,则铜参加反应的离子方程式为_____________ 。
②步骤Ⅱ中物质X可选用_________________ (填字母),该物质需过量的原因,其一是加快反应速率,其二是___________ 。
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是
(2)用H2O2、H2SO4混合溶液浸泡废印刷电路板可制备CuSO4以实现铜的回收利用,其离子方程式为
(3)用NH4NO3氧化海绵铜(含Cu的CuO)生产CuCl的部分流程如下:

①步骤I中反应温度不宜过高的原因是
②步骤Ⅱ中物质X可选用
a.Cu b.Cl2 c.H2O2 d.(NH4)2SO3
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐3】在元素周期表中除了同族元素的性质相似外,还有一些处于对角线上的元素的性质也呈现相似性。例如Li和Mg、Be和Al、B和Si,这种相似关系称为对角线关系,也称对角线规则。回答下列问题:
(1)Ge与Si同主族,二者属于周期表中____________ 区元素;Ge能与NaOH溶液反应生成Na2GeO3,其中发生反应的化学方程式为_____________ 。
(2)基态Mg原子和基态A1原子中第一电离能较大的是___________ ,原因为____________ 。
(3)硼氢化钠(NaBH4)是有机合成中常用的还原剂。
①硼氢化钠中存在的化学键为_____________ (填标号)。
a.离子键 c.氢键 b.共价键 d.配位键
②_____________ gNaBH4的还原能力与标准状况下22.4LH2的还原能力相当(还原能力即生成失去电子的量)。
(4)半径:Mg2+____________ Al3+(填“>”或“<”),若某溶液中的金属阳离子只含Mg2+或Al3+,验证金属离子的方法及现象为____________ 。
(1)Ge与Si同主族,二者属于周期表中
(2)基态Mg原子和基态A1原子中第一电离能较大的是
(3)硼氢化钠(NaBH4)是有机合成中常用的还原剂。
①硼氢化钠中存在的化学键为
a.离子键 c.氢键 b.共价键 d.配位键
②
(4)半径:Mg2+
您最近半年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】按要求回答下列问题:
(1)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ (填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_________ 。常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡___________ 移动(填“向左”“向右”或“不”)。试计算溶液中 =
=___________ (常温下H2SO3的电离平衡常数K2=6.0×10-8)。
(2)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O +I2=2I-+S4O
+I2=2I-+S4O )。
)。
取100.00 mL水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为___________ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为___________ mg·L-1。上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏___________ 。(填“高”或“低”)
(1)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显 =
=(2)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O
 +I2=2I-+S4O
+I2=2I-+S4O )。
)。取100.00 mL水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐2】亚硫酰氯( ,熔点
,熔点 ,沸点
,沸点 ,易水解生成
,易水解生成 和
和 )是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
)是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
方法1:以五氯化磷和二氧化硫为原料,发生反应:
方法2:以三氧化硫和二氯化硫为原料。
(1)方法1反应的过程中是否存在电子转移_______ ?
(2)写出方法2的化学方程式_______ 。
(3)某科研小组测定亚硫酰氯产品的纯度。步骤如下:
步骤一、用分析天平准确称取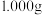 样品,小心地将样品溶于
样品,小心地将样品溶于 的氢氧化钠溶液中,充分反应后,配成
的氢氧化钠溶液中,充分反应后,配成 试样溶液。
试样溶液。
步骤二、用移液管吸取 试样溶液于
试样溶液于 碘量瓶中,加入两滴对硝基苯酚指示剂,滴加
碘量瓶中,加入两滴对硝基苯酚指示剂,滴加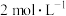 盐酸至黄色刚好消失,加入
盐酸至黄色刚好消失,加入 碘标准溶液,避光放置
碘标准溶液,避光放置 。
。
步骤三、用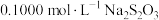 标准溶液返滴定过量的
标准溶液返滴定过量的 ,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液
,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液 。
。
①指出步骤一中“配成 试样溶液”所必需的定量玻璃仪器的名称
试样溶液”所必需的定量玻璃仪器的名称_______ 。
②指出步骤二中滴加盐酸的目的_______ 。
③叙述步骤三中滴定终点的现象_______ 。
④计算样品的纯度(用含有V的代数式表示)_______ 。
 ,熔点
,熔点 ,沸点
,沸点 ,易水解生成
,易水解生成 和
和 )是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:
)是一种重要的化学试剂,广泛用于有机合成。制备亚硫酰氯的两种方法:方法1:以五氯化磷和二氧化硫为原料,发生反应:

方法2:以三氧化硫和二氯化硫为原料。
(1)方法1反应的过程中是否存在电子转移
(2)写出方法2的化学方程式
(3)某科研小组测定亚硫酰氯产品的纯度。步骤如下:
步骤一、用分析天平准确称取
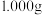 样品,小心地将样品溶于
样品,小心地将样品溶于 的氢氧化钠溶液中,充分反应后,配成
的氢氧化钠溶液中,充分反应后,配成 试样溶液。
试样溶液。步骤二、用移液管吸取
 试样溶液于
试样溶液于 碘量瓶中,加入两滴对硝基苯酚指示剂,滴加
碘量瓶中,加入两滴对硝基苯酚指示剂,滴加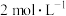 盐酸至黄色刚好消失,加入
盐酸至黄色刚好消失,加入 碘标准溶液,避光放置
碘标准溶液,避光放置 。
。步骤三、用
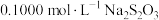 标准溶液返滴定过量的
标准溶液返滴定过量的 ,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液
,近终点时加入淀粉溶液,继续滴定至终点,消耗标准溶液 。
。①指出步骤一中“配成
 试样溶液”所必需的定量玻璃仪器的名称
试样溶液”所必需的定量玻璃仪器的名称②指出步骤二中滴加盐酸的目的
③叙述步骤三中滴定终点的现象
④计算样品的纯度(用含有V的代数式表示)
您最近半年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】请根据所学知识回答:
(1) 是温室气体,可用NaOH溶液吸收得到
是温室气体,可用NaOH溶液吸收得到 或
或 。已知:25℃时,
。已知:25℃时, ,
,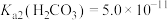 。
。
① 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式___________ 。NaOH溶液吸收 得到的某溶液中,当
得到的某溶液中,当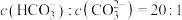 时,溶液的pH=
时,溶液的pH=___________ 。
②泡沫灭火器中通常装有 溶液和
溶液和 溶液,请写出这两种溶液混合时的离子反应方程式
溶液,请写出这两种溶液混合时的离子反应方程式___________ 。
(2)某温度下,水的离子积常数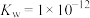 ,该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为
,该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为_______ 。
(3)莫尔盐 是一种常用原料。在
是一种常用原料。在 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取a克产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)
固体可制备莫尔盐晶体,为了测定产品纯度,称取a克产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)
滴定终点的现象是_______ ;通过实验数据,计算该产品的纯度为_______ (用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_______ 。
A.锥形瓶用待装液润洗
B.滴定达到终点时,俯视刻度线读数
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
(1)
 是温室气体,可用NaOH溶液吸收得到
是温室气体,可用NaOH溶液吸收得到 或
或 。已知:25℃时,
。已知:25℃时, ,
,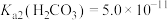 。
。①
 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式 得到的某溶液中,当
得到的某溶液中,当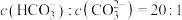 时,溶液的pH=
时,溶液的pH=②泡沫灭火器中通常装有
 溶液和
溶液和 溶液,请写出这两种溶液混合时的离子反应方程式
溶液,请写出这两种溶液混合时的离子反应方程式(2)某温度下,水的离子积常数
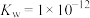 ,该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为
,该温度下,将pH=1的HCl溶液与pH=10的NaOH溶液混合并保持恒温,忽略混合前后溶液体积的变化。欲使混合溶液pH=3,则盐酸溶液与NaOH溶液的体积比为(3)莫尔盐
 是一种常用原料。在
是一种常用原料。在 溶液中,加入
溶液中,加入 固体可制备莫尔盐晶体,为了测定产品纯度,称取a克产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)
固体可制备莫尔盐晶体,为了测定产品纯度,称取a克产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如表:(已知莫尔盐的分子量为392)| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液体积/mL 溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.锥形瓶用待装液润洗
B.滴定达到终点时,俯视刻度线读数
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
您最近半年使用:0次



