氧化还原反应在工农业生产和日常生活中有广泛的应用,回答下列问题:
(1)罐头厂在装食品罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质,此类食物防腐剂应具有________ (填“氧化性”或“还原性”)。
(2)氯气是一种重要的工业原料且HCl遇NH3会产生NH4Cl,NH4Cl为白色固体。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是________ 。
A.若管道漏气遇NH3就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1分子N2有6个电子转移
(3)菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同时食用会生成有毒的+3价砷。下列说法中,正确的是(________ )
A.在该反应中维生素C作催化剂
B.由上述信息可推知砒霜中含有的砷是+3价
C.上述反应中维生素C作氧化剂
D.因为河虾中含有砷元素,所以不能食用
(4)在酸性条件下,Fe2O 容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O
容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O 、Fe2+、H+、H2O、Cu2O、Cu2+,则该反应中氧化剂的是
、Fe2+、H+、H2O、Cu2O、Cu2+,则该反应中氧化剂的是________ ,还原剂是________ 。
(1)罐头厂在装食品罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质,此类食物防腐剂应具有
(2)氯气是一种重要的工业原料且HCl遇NH3会产生NH4Cl,NH4Cl为白色固体。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇NH3就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1分子N2有6个电子转移
(3)菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同时食用会生成有毒的+3价砷。下列说法中,正确的是(
A.在该反应中维生素C作催化剂
B.由上述信息可推知砒霜中含有的砷是+3价
C.上述反应中维生素C作氧化剂
D.因为河虾中含有砷元素,所以不能食用
(4)在酸性条件下,Fe2O
 容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O
容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O 、Fe2+、H+、H2O、Cu2O、Cu2+,则该反应中氧化剂的是
、Fe2+、H+、H2O、Cu2O、Cu2+,则该反应中氧化剂的是
更新时间:2017-10-11 22:03:39
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用2FeCl3+Cu=CuCl2+2X表示。

(1)上式中X的化学式为________ 。
(2)在上述反应中,氧化剂为________ ,氧化产物为________ ,将两者的氧化性相比较,________ 的氧化性更强。
(3)若有32 g铜被氧化,则参与反应的FeCl3的质量为________ g。
(4)该反应的离子方程式为________________________________________________ 。

(1)上式中X的化学式为
(2)在上述反应中,氧化剂为
(3)若有32 g铜被氧化,则参与反应的FeCl3的质量为
(4)该反应的离子方程式为
您最近一年使用:0次
【推荐2】如下图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
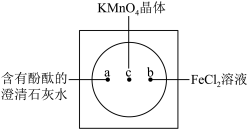
(1)氧化剂与还原剂物质的量之比为____________ ,氧化产物为_______ 。
(2)产生0.1molCl2,则转移电子的物质的量为______ mol。
(3)b处离子方程式是___________ 。
(4)高锰酸钾标准溶液经常用来滴定测量物质的含量。配平并完成下列高锰酸钾滴定草酸反应的离子方程式:_____  +
+______ H2C2O4+______  =
=____  +
+_____ CO2↑+___________

(1)氧化剂与还原剂物质的量之比为
(2)产生0.1molCl2,则转移电子的物质的量为
(3)b处离子方程式是
(4)高锰酸钾标准溶液经常用来滴定测量物质的含量。配平并完成下列高锰酸钾滴定草酸反应的离子方程式:
 +
+ =
= +
+
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】常温下已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
(1)高碘酸是________ (填“强酸”或“弱酸”),理由是______________________ 。
(2)0.01mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合所得溶液中 与Na+的浓度关系是
与Na+的浓度关系是________________ (填“大于”“小于”或“等于”)。
(3)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的还原剂是__________________ ,该反应的离子方程式可表示为__________________________________________________________________________________________________ 。
(1)高碘酸是
(2)0.01mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合所得溶液中
 与Na+的浓度关系是
与Na+的浓度关系是(3)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的还原剂是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】氧化还原反应在高中化学中是一类重要的反应类型。FeCl3、KClO3是中学化学中常用的氧化剂。回答下列问题:
(1)下列基本反应类型中一定属于氧化还原反应的是_______(填字母)。
(2)实验室迅速制备少量氯气可利用如下反应:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)。
①上述反应中被还原的元素为_______ (填元素符号)。
②MnO 与Fe2+反应生成Mn2+,反应后Fe2+转化为
与Fe2+反应生成Mn2+,反应后Fe2+转化为_______ ,Fe2+发生_______ 反应(填“氧化”或“还原”。)
③配平以下化学方程式并用双线桥标出电子转移的方向和数目:_______ 。
口KMnO4+口HCl(浓)→口KCl+口MnCl2+口Cl2↑+口H2O(未配平)
(3)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用2FeCl3+Cu=CaCl2+2X表示。
①上式中X的化学式为_______ 。
②若有32g铜被氧化,则参与反应的FeCl3的质量为_______ g。
③该反应的离子方程式为_______ 。
(1)下列基本反应类型中一定属于氧化还原反应的是_______(填字母)。
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
①上述反应中被还原的元素为
②MnO
 与Fe2+反应生成Mn2+,反应后Fe2+转化为
与Fe2+反应生成Mn2+,反应后Fe2+转化为③配平以下化学方程式并用双线桥标出电子转移的方向和数目:
口KMnO4+口HCl(浓)→口KCl+口MnCl2+口Cl2↑+口H2O(未配平)
(3)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用2FeCl3+Cu=CaCl2+2X表示。
①上式中X的化学式为
②若有32g铜被氧化,则参与反应的FeCl3的质量为
③该反应的离子方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】湿润的淀粉碘化钾试纸接触某物质而显蓝色,该物质可能是_______ 。
①Cl2 ②碘水 ③KBr ④溴化氢 ⑤HCl ⑥溴蒸气
①Cl2 ②碘水 ③KBr ④溴化氢 ⑤HCl ⑥溴蒸气
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】铁是人类较早使用的金属之一,如图为铁及其化合物的“价—类”二维图。
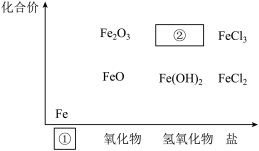
(1)填写二维图缺失的类别①___ 和化学式②___ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:①Cl2②Fe③NaOH④H2SO4⑤AgNO3。从物质类别上看,FeCl3属于___ ,可能与___ 发生反应(填序号);从化合价角度看,Fe3+具有___ 性,可能与___ 发生反应(填序号)。
(3)下列含铁元素物质既有氧化性又有还原性的是___ (用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(4)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是___ 。
(5)检验溶液中存在Fe3+的试剂是___ ,证明Fe3+存在的现象是___ 。

(1)填写二维图缺失的类别①
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:①Cl2②Fe③NaOH④H2SO4⑤AgNO3。从物质类别上看,FeCl3属于
(3)下列含铁元素物质既有氧化性又有还原性的是
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(4)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是
(5)检验溶液中存在Fe3+的试剂是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O 。
上述反应中发生还原反应的过程是__________ →___________ 。
(2)已知KMnO4在酸性条件下氧化性增强,能得到更多的电子,若在稀硫酸中反应的氧化产物为乙酸,则还原产物为___________ ;若反应产生了12.0 mg乙酸,则转移的电子数目是________ 。
(3)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,该反应的化学方程式为__________________________________________________ 。
(4)1994年美国首次批准使用唾液酒精含量检测方法,成为血液、呼气之后的第三种检测手段。其原理是在乙醇氧化酶作用下,乙醇与氧气反应生成乙醛和过氧化氢,判断该条件下乙醇、氧气、乙醛和过氧化氢四种物质中氧化性最强的物质是________ (填写化学式)。
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O 。
上述反应中发生还原反应的过程是
(2)已知KMnO4在酸性条件下氧化性增强,能得到更多的电子,若在稀硫酸中反应的氧化产物为乙酸,则还原产物为
(3)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,该反应的化学方程式为
(4)1994年美国首次批准使用唾液酒精含量检测方法,成为血液、呼气之后的第三种检测手段。其原理是在乙醇氧化酶作用下,乙醇与氧气反应生成乙醛和过氧化氢,判断该条件下乙醇、氧气、乙醛和过氧化氢四种物质中氧化性最强的物质是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】(1)配平方程式 KMnO4+ HCl(浓)- KCl+ MnCl2+ Cl2↑+ H2O,并用双线法分析此反应;___ 。
(2)指出___ 是氧化剂,___ 元素被氧化,氧化产物是___ ,此反应中,HCl表现的性质有___ 性和___ 性。
(2)指出
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】图象具有直观、线索清晰、引导性强等特点,有利于提高统筹思维和概括能力。下图是氮元素的化合价与部分常见含氮物质的关系。

请回答下列问题:
(1)丙的化学式为_______ 。
(2)写出实验室制备甲的化学方程式:_______ ,收集甲物质的常用方法是_______ 。
(3)若己物质的水溶液呈浅绿色,向该溶液中加入稀硫酸,溶液变黄色,同时生成丙,写出该过程中发生反应的离子方程式:___________ 。
(4)丁是一种有颜色的气体,写出丁与水反应生成丙和戊的化学方程式,并用双线桥表示电子转移的情况:_______ 。
(5)常温下,戊的浓溶液可以用干燥的铁罐车运输,原因是_______ 。

请回答下列问题:
(1)丙的化学式为
(2)写出实验室制备甲的化学方程式:
(3)若己物质的水溶液呈浅绿色,向该溶液中加入稀硫酸,溶液变黄色,同时生成丙,写出该过程中发生反应的离子方程式:
(4)丁是一种有颜色的气体,写出丁与水反应生成丙和戊的化学方程式,并用双线桥表示电子转移的情况:
(5)常温下,戊的浓溶液可以用干燥的铁罐车运输,原因是
您最近一年使用:0次



