1 . 已知FeSO4有如图所示的转化关系,下列叙述正确的是

| A.M一定是红棕色粉末 |
| B.图中发生了3个氧化还原反应 |
| C.生成HNO3的反应中,浓硫酸表现强氧化性、难挥发性和强酸性 |
D.“褪色”的原因是SO2+Br2+2H2O=4H++ +2Br- +2Br- |
您最近一年使用:0次
解题方法
2 . 高铁酸钠(Na2FeO4)是一种优良的多功能水处理剂,具有很强的氧化性,工业上可采取干法和湿法制备Na2FeO4。回答下列问题:
(1)干法制备Na2FeO4,反应原理为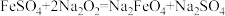 。
。
①Na2FeO4属于______________ (填“盐”“碱”或“氧化物”)。
②写出Na2O2的电子式:_______________ 。
③氧化性:Na2O2______________ (填“<”或“>”)Na2FeO4,每消耗1 mol FeSO4转移______________ mole-。
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是_______________ (填字母,下同)。_______________ 。
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度_______________ (填“>”“<”或“=”)0.2mol·L-1。
④写出湿法制备Na2FeO4的化学方程式:_______________ 。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为______________ (用分数表示, →Fe3+)。
→Fe3+)。
(1)干法制备Na2FeO4,反应原理为
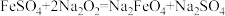 。
。①Na2FeO4属于
②写出Na2O2的电子式:
③氧化性:Na2O2
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是
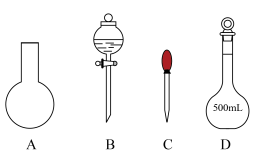
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度
④写出湿法制备Na2FeO4的化学方程式:
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为
 →Fe3+)。
→Fe3+)。
您最近一年使用:0次
3 . 我国的冶金工业十分发达,钢铁年产量已达到十亿吨,占世界产量的一半以上,同时有色金属产量也超过了七千万吨。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为___________ 。
(2)铝与 溶液反应的化学方程式为
溶液反应的化学方程式为___________ ;铝的化学性质较活泼,但在空气中不会完全锈蚀,其原因是___________ 。
(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为___________ ,当有 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为___________ 。
②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为___________ 。在碱性的废电解液中通入氯气可以将 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为___________ 。
(1)铜是人类最早使用的金属,其电阻率小、延展性好,常用于制作电路板,在使用氯化铁溶液蚀刻铜制电路板时,发生反应的化学方程式为
(2)铝与
 溶液反应的化学方程式为
溶液反应的化学方程式为(3)电镀是一种常见的金属处理工艺,然而在生产过程中,电镀厂会产生大量的高毒性废水,将其直接排放会造成严重的污染。因此,废水的处理是电镀行业面临的主要问题之一。
①在电镀之前,镀件需要用酸性
 溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的
溶液浸泡清洗。清洗废液的处理需要去除其中的悬浮颗粒物,并加入足量的 固体,将
固体,将 还原为
还原为 ,则还原过程中发生反应的离子方程式为
,则还原过程中发生反应的离子方程式为 被完全处理时,理论上需要加入
被完全处理时,理论上需要加入 的质量为
的质量为②为了减缓镀件表面的金属沉积速率,得到均匀、光滑的镀层,电解液中除重金属盐外,还需要加入剧毒的
 。已知
。已知 中各原子均满足8电子稳定结构,则
中各原子均满足8电子稳定结构,则 的电子式为
的电子式为 氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
氧化,并生成两种无毒的氧化产物(其中一种为大气中占比最多的成分),则反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 某钒催化剂在一定条件下形成相邻的氧化还原位和酸性吸附位,该催化剂催化 脱除电厂烟气中NO的反应机理如图所示。
脱除电厂烟气中NO的反应机理如图所示。
 脱除电厂烟气中NO的反应机理如图所示。
脱除电厂烟气中NO的反应机理如图所示。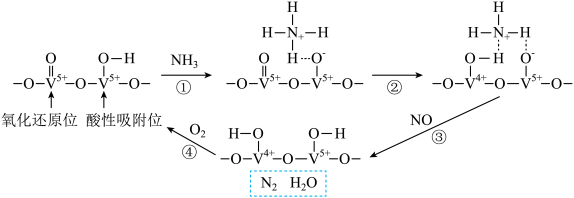
| A.反应①~④均为氧化还原反应 |
B.消耗1mol  ,理论上可处理2mol NO ,理论上可处理2mol NO |
C.反应②为 |
D.总反应方程式 |
您最近一年使用:0次
2024高三·全国·专题练习
5 . 含氮化合物(NOx、NO 等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
 .NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。
.NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。___________ 。用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程式为___________ 。
 .用铁去除含氮废水中的硝酸盐(
.用铁去除含氮废水中的硝酸盐( )是重要的方法。一种去除
)是重要的方法。一种去除 的过程如图:
的过程如图:___________ 。酸化废水与铁粉反应的离子方程式是___________ 。
(3)研究发现Fe2+能与FeO(OH)反应生成Fe3O4,在去除 的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致
的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致 的去除率低。若要提高
的去除率低。若要提高 的去除率,可采取的措施是
的去除率,可采取的措施是___________ 。
 .测定某废水中
.测定某废水中 含量。先取V mL含
含量。先取V mL含 水样并将O2去除,加入催化剂、V1 mL c1 mol·L-1 FeSO4标准溶液(过量),再加入稀硫酸;最后用c2 mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+,滴定至终点时消耗V2 mL。
水样并将O2去除,加入催化剂、V1 mL c1 mol·L-1 FeSO4标准溶液(过量),再加入稀硫酸;最后用c2 mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+,滴定至终点时消耗V2 mL。
已知:3Fe2++ +4H+=NO↑+3Fe3++2H2O,
+4H+=NO↑+3Fe3++2H2O,  +14H++6Fe2+=2Cr3++6Fe3++7H2O。
+14H++6Fe2+=2Cr3++6Fe3++7H2O。
(4)若需要480 mL FeSO4、K2Cr2O7标准溶液,配制时所需的仪器有天平、量筒、烧杯、玻璃棒、___________ 。
(5)加入稀硫酸的作用是___________ 。
(6)水样中NO 的含量为
的含量为___________ mol·L-1(用含c1、c2、V1、V2、V的代数式表示)。
 等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
等)是大气主要污染物之一,消除含氮化合物的污染备受关注。 .NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。
.NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。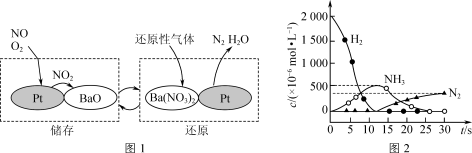
 .用铁去除含氮废水中的硝酸盐(
.用铁去除含氮废水中的硝酸盐( )是重要的方法。一种去除
)是重要的方法。一种去除 的过程如图:
的过程如图: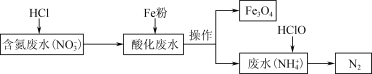
(3)研究发现Fe2+能与FeO(OH)反应生成Fe3O4,在去除
 的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致
的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致 的去除率低。若要提高
的去除率低。若要提高 的去除率,可采取的措施是
的去除率,可采取的措施是 .测定某废水中
.测定某废水中 含量。先取V mL含
含量。先取V mL含 水样并将O2去除,加入催化剂、V1 mL c1 mol·L-1 FeSO4标准溶液(过量),再加入稀硫酸;最后用c2 mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+,滴定至终点时消耗V2 mL。
水样并将O2去除,加入催化剂、V1 mL c1 mol·L-1 FeSO4标准溶液(过量),再加入稀硫酸;最后用c2 mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+,滴定至终点时消耗V2 mL。已知:3Fe2++
 +4H+=NO↑+3Fe3++2H2O,
+4H+=NO↑+3Fe3++2H2O,  +14H++6Fe2+=2Cr3++6Fe3++7H2O。
+14H++6Fe2+=2Cr3++6Fe3++7H2O。(4)若需要480 mL FeSO4、K2Cr2O7标准溶液,配制时所需的仪器有天平、量筒、烧杯、玻璃棒、
(5)加入稀硫酸的作用是
(6)水样中NO
 的含量为
的含量为
您最近一年使用:0次
名校
6 . 氮、磷及其化合物应用广泛。磷元素有白磷、红磷等单质,白磷(P4)分子结构及晶胞如下图所示,实验室常用CuSO4溶液吸收有毒气体PH3,生成H3PO4、H2SO4和Cu。P元素可形成多种含氧酸,其中次磷酸(H3PO2)为一元弱酸;磷酸可与铁反应,在金属表面生成致密且难溶于水的磷酸盐膜。

| A.用氨水和AlCl3溶液制备Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| B.工业上用足量氨水吸收SO2:NH3·H2O+SO2=NH4HSO3 |
| C.用CuSO4溶液吸收PH3:PH3+4CuSO4+4H2O=4Cu↓+H3PO4+4H2SO4 |
| D.次磷酸与足量NaOH溶液反应:H3PO2+3NaOH=Na3PO2+3H2O |
您最近一年使用:0次
名校
解题方法
7 . 利用工业废气NO生产 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中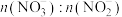 都为
都为 。下列说法错误的是
。下列说法错误的是
 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中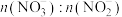 都为
都为 。下列说法错误的是
。下列说法错误的是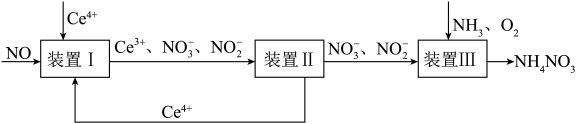
A.装置Ⅰ中若有 参与反应,则转移 参与反应,则转移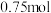 电子 电子 |
B.装置Ⅰ中反应为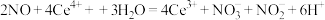 |
C.装置Ⅲ中氧化剂和还原剂的物质的量之比为 |
D.装置Ⅲ中 和 和 的体积比 的体积比 时,可实现原子利用率最大化 时,可实现原子利用率最大化 |
您最近一年使用:0次
解题方法
8 . 高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。
(1)电解法。以铁为阳极,石墨为阴极,在通电条件下,发生反应: ,物质X的化学式为
,物质X的化学式为___________ 。
(2)高温熔融氧化法。将过氧化钠与硫酸亚铁加热至700℃,发生反应: ,其中,氧化产物是
,其中,氧化产物是___________ ,用生成1mol氧气所转移的电子数为___________ 。
(3)次氯酸钠氧化法___________ 。
②副产品的成分为___________ 。
(1)电解法。以铁为阳极,石墨为阴极,在通电条件下,发生反应:
 ,物质X的化学式为
,物质X的化学式为(2)高温熔融氧化法。将过氧化钠与硫酸亚铁加热至700℃,发生反应:
 ,其中,氧化产物是
,其中,氧化产物是(3)次氯酸钠氧化法
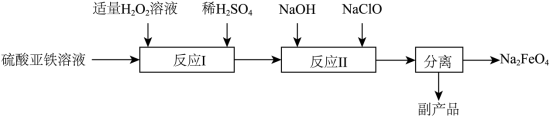
②副产品的成分为
您最近一年使用:0次
名校
解题方法
9 . 工业废水中的氨氮(以 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。
(1)微生物法:酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。
① 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
② 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为_______ 。
(2)次氯酸钠氧化法:向氨氮废水中加入 ,氨氮转化为
,氨氮转化为 而除去。
而除去。
① 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
②一定 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。 :
: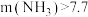 时,总氮的去除率随
时,总氮的去除率随 :
: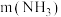 的增大不升反降的原因是
的增大不升反降的原因是_______ 。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,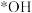 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。_______ 。
②其它条件不变调节废水的 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是_______ 。 晶体进行纯度测定:
晶体进行纯度测定:
a.称取 样品,将其配成
样品,将其配成 溶液。
溶液。
b.先向锥形瓶内加入一定浓度的 溶液,加热至
溶液,加热至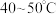 。冷却后再向其中加入
。冷却后再向其中加入
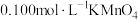 溶液,充分混合。
溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液 。
。
(NaNO2与 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)
通过计算,该样品中 的质量分数是
的质量分数是_______ 。(写出计算过程)
 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。(1)微生物法:酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。①
 转化为
转化为 的离子方程式为
的离子方程式为②
 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为(2)次氯酸钠氧化法:向氨氮废水中加入
 ,氨氮转化为
,氨氮转化为 而除去。
而除去。①
 氧化
氧化 的离子方程式为
的离子方程式为②一定
 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。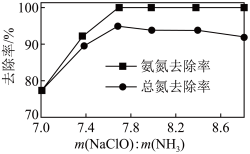
 :
: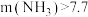 时,总氮的去除率随
时,总氮的去除率随 :
: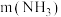 的增大不升反降的原因是
的增大不升反降的原因是(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,
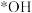 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。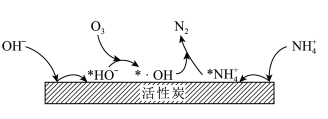
②其它条件不变调节废水的
 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是
 晶体进行纯度测定:
晶体进行纯度测定:a.称取
 样品,将其配成
样品,将其配成 溶液。
溶液。b.先向锥形瓶内加入一定浓度的
 溶液,加热至
溶液,加热至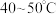 。冷却后再向其中加入
。冷却后再向其中加入
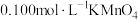 溶液,充分混合。
溶液,充分混合。c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液
 。
。(NaNO2与
 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)通过计算,该样品中
 的质量分数是
的质量分数是
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
10 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。 的一种制备方法如下图所示:
的一种制备方法如下图所示: 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为_______ ,生成的沉淀与硝酸反应,生成_______ 后可循环使用。
 的一种制备方法如下图所示:
的一种制备方法如下图所示:
 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为
您最近一年使用:0次



