河南省济源第一中学2022-2023学年高二上学期开学考试 化学试题
河南
高二
开学考试
2024-01-20
25次
整体难度:
适中
考查范围:
化学反应原理、化学与STSE、认识化学科学
河南省济源第一中学2022-2023学年高二上学期开学考试 化学试题
河南
高二
开学考试
2024-01-20
25次
整体难度:
适中
考查范围:
化学反应原理、化学与STSE、认识化学科学
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 在日常生活中,下列做法与化学反应速率有关的是
| A.提倡使用“公筷”聚餐 | B.经常用肥皂洗手 |
| C.将食品贮存于冰箱中 | D.鼓励使用共享单车 |
【知识点】 化学反应的速率
您最近一年使用:0次
2020-11-04更新
|
170次组卷
|
3卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
您最近一年使用:0次
2020-11-04更新
|
146次组卷
|
4卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
3. 下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡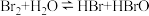 ,当加入硝酸银溶液后,溶液颜色变浅 ,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应 ,达平衡后,升高温度体系颜色变深 ,达平衡后,升高温度体系颜色变深 |
D.对于 达平衡后,缩小容器体积可使体系颜色变深 达平衡后,缩小容器体积可使体系颜色变深 |
您最近一年使用:0次
2024-01-16更新
|
69次组卷
|
3卷引用: 河南省济源第一中学2022-2023学年高二上学期开学考试 化学试题
单选题
|
适中(0.65)
名校
4. 化学上,单位质量的纯物质完全燃烧生成稳定的氧化物放出的热量叫热值(kJ·g-1)。已知几种物质的燃烧热如下表所示:
常温常压下,上述可燃物中热值最大的是
| 物质 | CH4(g) | CO(g) | CH3CH2OH(l) | CH3CH2CH3(g) |
| 燃烧热(ΔH )/(kJ · mol-1) | -890 | - 283 | -1 366 | -2 220 |
| A.CH4 | B.CO |
| C.CH3CH2CH3 | D.CH3CH2OH |
【知识点】 化学反应热的计算
您最近一年使用:0次
2020-11-04更新
|
99次组卷
|
2卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
5. 已知苯酚(C6H5OH)与Fe3+反应生成[Fe(C6H5O)6]3-(紫色)。将6mL0. 1mol·L-1KI溶液和1mL 0.1 mol·L-1FeCl3溶液混合,发生反应:2Fe3+(aq) +2I-( aq)  2Fe2+ (aq) +I2(aq) ,下列有关该反应的说法错误的是
2Fe2+ (aq) +I2(aq) ,下列有关该反应的说法错误的是
 2Fe2+ (aq) +I2(aq) ,下列有关该反应的说法错误的是
2Fe2+ (aq) +I2(aq) ,下列有关该反应的说法错误的是| A.加入2 mL四氯化碳,振荡,平衡向右移动 |
| B.经四氯化碳多次萃取,在分离后的水溶液中滴加苯酚溶液,若溶液呈紫色,说明该反应是可逆反应 |
| C.加入少量I2固体,平衡向左移动 |
D.平衡常数的表达式为K=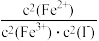 |
您最近一年使用:0次
2020-11-04更新
|
149次组卷
|
3卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题
河南省重点高中2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】高中化学20210513-004【2021】【高二下】 河南省济源第一中学2022-2023学年高二上学期开学考试 化学试题
单选题
|
较易(0.85)
名校
解题方法
6. 软脂酸在人体中氧化可为人类提供能源,热化学方程式为CH3(CH2)14COOH(s) + 23O2(g)=16CO2(g) +16H2O(1) ΔH 。 已知1 g CH3(CH2)14COOH(s)完全燃烧生成CO2(g)和H2O(1),释放38.97kJ热量,则ΔH等于
| A.-9976 kJ·mol-1 | B.+9976 kJ·mol-1 |
| C.-9788 kJ·mol-1 | D.+9788 kJ·mol-1 |
【知识点】 化学反应热的计算 依据热化学方程式的计算解读
您最近一年使用:0次
2020-11-04更新
|
117次组卷
|
2卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
7. 已知热化学方程式:
①C(s) +CO2(g)=2CO(g) ΔH1
②C(s) + O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
③C(s) +O2(g)=CO2(g) ΔH3
④2CO(g) +O2(g)=2CO2(g) ΔH4
下列有关判断正确的是
①C(s) +CO2(g)=2CO(g) ΔH1
②C(s) +
 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2③C(s) +O2(g)=CO2(g) ΔH3
④2CO(g) +O2(g)=2CO2(g) ΔH4
下列有关判断正确的是
| A.ΔH1<ΔH2 | B.ΔH1=ΔH3+ΔH4 |
| C.ΔH2<ΔH3 | D.ΔH3=ΔH2+ ΔH4 ΔH4 |
【知识点】 盖斯定律及其有关计算 反应热大小比较解读
您最近一年使用:0次
2020-11-04更新
|
164次组卷
|
2卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
解题方法
8. 我国科学家研究利用CO(g) + H2O(g) CO2(g) + H2(g)制备H2 ,其能量变化如图所示。
CO2(g) + H2(g)制备H2 ,其能量变化如图所示。
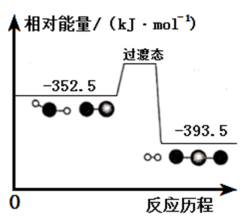
下列说法错误的是
 CO2(g) + H2(g)制备H2 ,其能量变化如图所示。
CO2(g) + H2(g)制备H2 ,其能量变化如图所示。
下列说法错误的是
| A.上述反应中既有极性键的断裂,又有极性键和非极性键的形成 |
| B.加入催化剂,可以提高反应物的相对能量 |
| C.上述反应中,正反应活化能小于逆反应活化能 |
D.CO2(g) +H2(g) CO(g) +H2O(g) ΔH = +41 kJ·mol-1 CO(g) +H2O(g) ΔH = +41 kJ·mol-1 |
您最近一年使用:0次
2020-11-04更新
|
143次组卷
|
3卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
9. 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1 mol可燃冰( CH4·8H2O)含有的质子数为80NA |
| B.反应6NO2 +8NH3 =7N2+ 12H2O中,6 mol NO2完全反应时,生成氧化产物的分子数为7 NA |
C.一定条件下1 mol Cl2和2 mol PCl3发生反应PCl3+Cl2 PCl5,增加的极性键数为2 NA PCl5,增加的极性键数为2 NA |
D.反应2N2O5(g)  4NO2(g) +O2(g) ΔH = +109.8kJ ·mol-1中,吸收54.9 kJ热量时转移的电子数为2 NA 4NO2(g) +O2(g) ΔH = +109.8kJ ·mol-1中,吸收54.9 kJ热量时转移的电子数为2 NA |
您最近一年使用:0次
2020-11-04更新
|
131次组卷
|
2卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
10. 已知断裂1 mol气态分子AB中共价键变成气态A和B原子所需要吸收的能量叫A—B键的键能。几种化学键的键能数据如下表所示:
下列说法正确的是
| 化学键 | Br-Br | F-F | H-F | H -Br | C-C | C≡C | H-H |
| 键能/(kJ·mol-1) | 194 | 157 | 568 | 366 | 348 | 812 | 436 |
| A.H-F键的稳定性比H- Br键弱 |
| B.2HBr(g)=H2(g) +Br2(1) ΔH = +102 kJ·mol-1 |
| C.F2(g)=2F(g) ΔH = -157 kJ·mol-1 |
| D.2HBr(g) +F2(g) =Br2(g) +2HF(g) ΔH = -441 kJ·mol-1 |
您最近一年使用:0次
2020-11-04更新
|
252次组卷
|
3卷引用:河南省重点高中2020-2021学年高二上学期期中考试化学试题



