三轮冲刺2020届高三化学考题必刷——物质反应原理探究分析题
全国
高三
专题练习
2020-02-11
15次
整体难度:
适中
考查范围:
有机化学基础、化学实验基础、认识化学科学、化学反应原理、常见无机物及其应用
三轮冲刺2020届高三化学考题必刷——物质反应原理探究分析题
全国
高三
专题练习
2020-02-11
15次
整体难度:
适中
考查范围:
有机化学基础、化学实验基础、认识化学科学、化学反应原理、常见无机物及其应用
一、解答题 添加题型下试题
1. 向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___ 反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___ ?理由是___ 。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___ mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___ mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___ mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___ 。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=
若测得反应后n(Br-)=
若测得反应后n(Br-)=
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
| 实验操作步骤 | 实验现象 | 结论 |
您最近一年使用:0次
2020-02-09更新
|
361次组卷
|
7卷引用:2013届安徽省合肥市高三第三次教学质量检测理综化学试卷
(已下线)2013届安徽省合肥市高三第三次教学质量检测理综化学试卷2020届高三化学二轮每周大题必练— ——反应原理的探究型实验2020届高三化学二轮冲刺新题专练——乙醇的性质和应用夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——氯及其化合物强化练三轮冲刺2020届高三化学考题必刷——物质反应原理探究分析题安徽省长丰县第一中学2019-2020学年高二下学期第一次月考化学试题(已下线)【教材实验热点】21 乙醛的性质实验
解答题-工业流程题
|
适中(0.65)
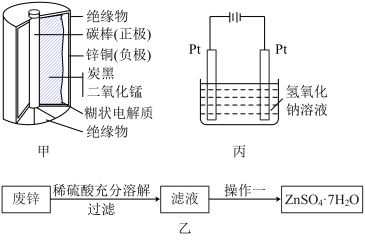
2. 普通干电池,是一种广泛使用的可移动化学电源,其结构如图甲所示,电池反应是: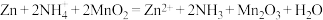 但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
实验一、用废锌制取防腐剂皓矾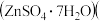 图乙
图乙
 操作一的名称是:
操作一的名称是:______ 。
 锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物
锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物 四羟基锌酸钠
四羟基锌酸钠 和
和 ,该配合物中心离子是
,该配合物中心离子是______ ,配位数是 ______ 。
实验二、经查相关资料:锰的氧化物都不溶于水,且都能与浓盐酸反应生成氯气.将分离得到的黑色粉末在空气中充分灼烧,并做相关实验,回答下列问题:
 灼烧的目的是:
灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物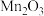 和
和 。
。
 写出
写出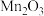 与浓盐酸反应的离子方程式:
与浓盐酸反应的离子方程式: ______ 。
 取
取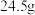 上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气
上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气 ,则混合物中
,则混合物中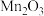 和
和 质量之比是:
质量之比是: ______ 。
实验三、查询资料得知,还可以通过电解的方式,将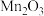 转化为
转化为 ,同学们设计了这样的一个装置
,同学们设计了这样的一个装置 图丙
图丙 ,将混合物粉末调成糊状,附在其中的
,将混合物粉末调成糊状,附在其中的 ______ 边电极上 填左或者右
填左或者右 ,该电极上发生的电极反应式是:
,该电极上发生的电极反应式是: ______  在电解过程中溶液的pH将
在电解过程中溶液的pH将 ______ 填变大、变小、不变 。
。
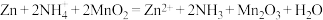 但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理 实验一、用废锌制取防腐剂皓矾
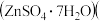 图乙
图乙

 操作一的名称是:
操作一的名称是: 锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物
锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物 四羟基锌酸钠
四羟基锌酸钠 和
和 ,该配合物中心离子是
,该配合物中心离子是实验二、经查相关资料:锰的氧化物都不溶于水,且都能与浓盐酸反应生成氯气.将分离得到的黑色粉末在空气中充分灼烧,并做相关实验,回答下列问题:
 灼烧的目的是:
灼烧的目的是: 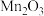 和
和 。
。 写出
写出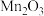 与浓盐酸反应的离子方程式:
与浓盐酸反应的离子方程式:  取
取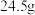 上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气
上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气 ,则混合物中
,则混合物中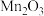 和
和 质量之比是:
质量之比是: 实验三、查询资料得知,还可以通过电解的方式,将
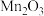 转化为
转化为 ,同学们设计了这样的一个装置
,同学们设计了这样的一个装置 图丙
图丙 ,将混合物粉末调成糊状,附在其中的
,将混合物粉末调成糊状,附在其中的  填左或者右
填左或者右 ,该电极上发生的电极反应式是:
,该电极上发生的电极反应式是:  在电解过程中溶液的pH将
在电解过程中溶液的pH将  。
。
【知识点】 基于氧化还原反应守恒规律的计算解读 电解原理的应用 蒸发与结晶解读
您最近一年使用:0次
2020-01-07更新
|
89次组卷
|
2卷引用:2020届高三化学二轮每周大题必练— ——反应原理的探究型实验
解答题-实验探究题
|
适中(0.65)
3. 某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是__________________________ (用化学方程式表示),所以他认为应该检验__________ (填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。

(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_______ 。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸; ④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用____________________________________ 。
(4)C装置中出现的现象是_______________________________________________ ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式___________________________ 。
(1)乙同学认为甲同学的结论是错误的,他的理由是

(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸; ④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用
(4)C装置中出现的现象是
您最近一年使用:0次
2016-12-09更新
|
900次组卷
|
4卷引用:2014届河北省唐山市高三4月第二次模拟理综化学试卷
(已下线)2014届河北省唐山市高三4月第二次模拟理综化学试卷2020届高三化学二轮每周大题必练— ——反应原理的探究型实验三轮冲刺2020届高三化学考题必刷——物质反应原理探究分析题三轮冲刺2020届高三化学考题必刷——“假设猜想型”探究分析题
解答题-实验探究题
|
适中(0.65)
名校
4. 为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
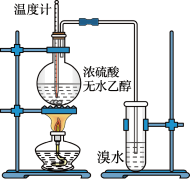
(1)写出甲同学实验中两个反应的化学方程式:_____________ 、___________________________ 。
(2)乙同学观察到的黑色物质是_____________ ,刺激性气体是_____________ 。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________ 。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
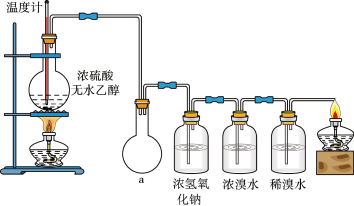
①设计装置a的作用是____________________
②浓溴水的作用是_______________________ ,稀溴水的作用是____________________ 。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中两个反应的化学方程式:
(2)乙同学观察到的黑色物质是
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是
②浓溴水的作用是
您最近一年使用:0次
2019-04-30更新
|
277次组卷
|
9卷引用:2011-2012学年江苏省无锡一中高二上学期期中考试化学试卷(选修)
(已下线)2011-2012学年江苏省无锡一中高二上学期期中考试化学试卷(选修)(已下线)2011-2012学年辽宁省开原高中高二下学期期中考试化学试卷(已下线)2011-2012学年河南省新郑一中高二下学期竞赛班期末考试化学试卷2015-2016学年河北省邯郸市鸡泽一中高二下学期期末化学试卷河北省曲阳县一中2018-2019学年高二下学期3月月考化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二下学期期中考试化学试题2020届高三化学二轮每周大题必练— ——反应原理的探究型实验三轮冲刺2020届高三化学考题必刷——物质反应原理探究分析题 内蒙古北京八中乌兰察布分校2020-2021学年高二上学期期中(学科素养评估二)考试化学试题
解答题-实验探究题
|
适中(0.65)
5. 根据图1、图2、图3及题中信息,回答下列问题
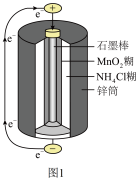
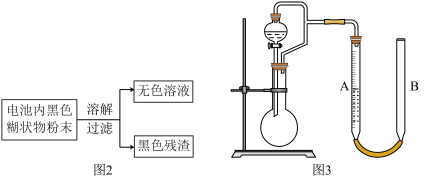
 图1是锌锰干电池基本构造图,该电池的负极材料是
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含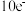 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是 ______ ;当电路中每通过 ,负极质量减少
,负极质量减少 ______ ;
 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
 图3是探究
图3是探究 在制
在制 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定: 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶 。
。
 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
 实验一、二中参加反应的
实验一、二中参加反应的 的物质的量之比为
的物质的量之比为 ______ 。


 图1是锌锰干电池基本构造图,该电池的负极材料是
图1是锌锰干电池基本构造图,该电池的负极材料是  离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含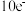 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是  ,负极质量减少
,负极质量减少  图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有  图3是探究
图3是探究 在制
在制 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定: 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶 。
。| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
| 实验一 | 足量 |  充分反应后未见黑色固体物质减少 充分反应后未见黑色固体物质减少 收集到112mL气体 收集到112mL气体 |  |
| 实验二 | 足量 和稀硫酸 和稀硫酸 |  充分反应后黑色粉末部分溶解 充分反应后黑色粉末部分溶解 收集到112mL气体 收集到112mL气体 |  |
 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意  实验一、二中参加反应的
实验一、二中参加反应的 的物质的量之比为
的物质的量之比为 【知识点】 锰锌干电池解读 过滤解读 化学实验方案的设计与评价
您最近一年使用:0次
2020-01-07更新
|
483次组卷
|
3卷引用:2020届高三化学二轮每周大题必练— ——反应原理的探究型实验
解答题-实验探究题
|
适中(0.65)
解题方法
6. 高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2 MnSO4+H2O。下列措施中,目的是加快化学反应速率的是
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________ (填标号)。
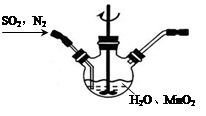
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓) 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________ (填标号)。






③若用空气代替N2进行实验,缺点是________ 。(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________ 。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________ 。
(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全:________ 。[查阅资料表明K2(H2SO4)=1.1×10-2]
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2
 MnSO4+H2O。下列措施中,目的是加快化学反应速率的是
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)
 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有




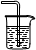

③若用空气代替N2进行实验,缺点是
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):
(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全:
您最近一年使用:0次
2016-12-09更新
|
324次组卷
|
2卷引用:2016届广东省广州市高三综合测试(一)理综化学试卷



