高一必修第一册(苏教2019版)专题4 第一单元 含硫化合物的性质 易错疑难集训
全国
高一
课后作业
2020-10-08
130次
整体难度:
较易
考查范围:
常见无机物及其应用、化学实验基础
高一必修第一册(苏教2019版)专题4 第一单元 含硫化合物的性质 易错疑难集训
全国
高一
课后作业
2020-10-08
130次
整体难度:
较易
考查范围:
常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 下列物质能使品红溶液褪色的是( )
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫
| A.仅①③④ | B.仅②④ |
| C.仅①②④ | D.①②③④ |
您最近一年使用:0次
2020-03-04更新
|
879次组卷
|
4卷引用:鲁科版(2019)高一必修第一册第三章易错疑难集训(二)
单选题
|
较易(0.85)
2. 将等物质的量的 和
和 混合后通入含有品红和
混合后通入含有品红和 的混合溶液中,发生的现象是( )
的混合溶液中,发生的现象是( )
①溶液很快褪色 ②溶液不褪色 ③有沉淀生成 ④溶液仍然透明
 和
和 混合后通入含有品红和
混合后通入含有品红和 的混合溶液中,发生的现象是( )
的混合溶液中,发生的现象是( )①溶液很快褪色 ②溶液不褪色 ③有沉淀生成 ④溶液仍然透明
| A.①和④ | B.①和③ | C.②和③ | D.②和④ |
【知识点】 氯气与还原性化合物的反应解读 二氧化硫 硫酸盐 二氧化硫的化学性质
您最近一年使用:0次
2020-03-04更新
|
1330次组卷
|
13卷引用:2010—2011学年福建省罗源一中高一3月月考化学试卷
(已下线)2010—2011学年福建省罗源一中高一3月月考化学试卷(已下线)2011-2012学年江苏省上冈高级中学高一下学期期中考试化学试卷(已下线)2011-2012学年广东省深圳高级中学高一下学期期中化学试卷2015-2016学年辽宁省大连二十中高一上学期期末考试化学试卷2015-2016学年河北省正定中学高一上学期期末化学试卷2015-2016学年浙江省温州第二外国语学校高一上期末化学试卷内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题浙江省温州市第二外国语学校2018-2019学年高一上学期期末考试化学试题广东省珠海一中高一化学下学期综合测试试卷鲁科版(2019)高一必修第一册第三章易错疑难集训(二)必修第二册RJ第5章第一节易错疑难集训(一)高一必修第一册(苏教2019版)专题4 第一单元 含硫化合物的性质 易错疑难集训人教版(2019)必修第二册第五章第一节 易错疑难集训
单选题
|
适中(0.65)
名校
解题方法
3. 下列说法正确的是( )
| A.浓硫酸和浓盐酸长期暴露在空气中浓度降低,其原因相同 |
| B.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同 |
| C.漂白粉和氢氧化钠长期暴露在空气中变质,反应原理相同 |
| D.能使品红溶液褪色的气体不一定是SO2 |
您最近一年使用:0次
2020-09-16更新
|
521次组卷
|
4卷引用:鲁科版(2019)高一必修第一册第三章易错疑难集训(二)
单选题
|
较易(0.85)
解题方法
4. 下列说法不正确的是( )
| A.SO2和CO2均有毒 |
| B.SO2和CO2均能与澄清石灰水反应,并有白色沉淀生成 |
| C.SO2具有漂白性,但通入石蕊试液中却不能使石蕊试液褪色 |
| D.SO2和Cl2均能使品红溶液褪色 |
您最近一年使用:0次
2020-09-16更新
|
93次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第三章易错疑难集训(二)
二、解答题 添加题型下试题
解答题-实验探究题
|
较易(0.85)
名校
解题方法
5. 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下实验装置:__ 。
(2)实验室可用装置E通过MnO2和浓盐酸反应制备Cl2,若有6molHCl参加反应,则转移电子的总数为___ 。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象分别是:B__ ,D___ 。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别是:B__ ,D__ 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会更强。他们将制得的SO2和Cl2按物质的量之比为1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析产生该现象的原因:__ (用化学方程式表示)。
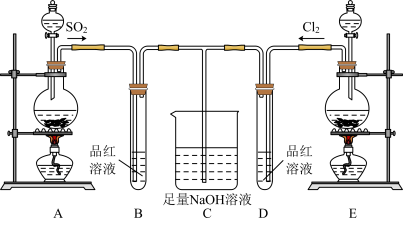
(2)实验室可用装置E通过MnO2和浓盐酸反应制备Cl2,若有6molHCl参加反应,则转移电子的总数为
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象分别是:B
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会更强。他们将制得的SO2和Cl2按物质的量之比为1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析产生该现象的原因:
您最近一年使用:0次
2020-09-16更新
|
149次组卷
|
8卷引用:2013-2014学年安徽省濉溪县高一上学期期末考试化学试卷
(已下线)2013-2014学年安徽省濉溪县高一上学期期末考试化学试卷(已下线)2013-2014学年河南省平顶山市高一第一学期期末调研考试化学试卷2014-2015甘肃省白银市会宁县五中高一上学期期末化学试卷【全国百强校】西藏自治区拉萨中学2017-2018学年高一下学期期中考试化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高一上学期期末考试化学试题鲁科版(2019)高一必修第一册第三章易错疑难集训(二)高一必修第一册(苏教2019版)专题4 第一单元 含硫化合物的性质 易错疑难集训陕西省西安市选课分科摸底考2023-2024学年高一下学期4月月考化学试题
解答题-实验探究题
|
较易(0.85)
6. 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带火星的木条插入试管C中,木条复燃。

请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是__ 。
(2)请设计一种实验方案,证明Na2O2与SO2反应生成的白色固体中含有Na2SO3:__ 。
(3)第2小组同学认为Na2O2与SO2反应除了能生成Na2SO3与O2外,还有Na2SO4生成。提出有Na2SO4生成这一猜想的理由是__ 。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理?__ (填“合理”或“不合理”)。请简要说出两点理由:①__ ;②__ 。

请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是
(2)请设计一种实验方案,证明Na2O2与SO2反应生成的白色固体中含有Na2SO3:
(3)第2小组同学认为Na2O2与SO2反应除了能生成Na2SO3与O2外,还有Na2SO4生成。提出有Na2SO4生成这一猜想的理由是

上述方案是否合理?
您最近一年使用:0次
2020-09-16更新
|
131次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第三章易错疑难集训(二)
解答题-实验探究题
|
较易(0.85)
解题方法
7. 为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10mL18mol•L-1`的浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。

(1)比较两实验装置,图2装置的优点是①__ ;②__ 。
(2)甲同学依据所学的化学知识认为还有一定量的H2SO4剩余,其理论依据是__ 。
(3)乙同学在实验结束后拆除图2装置时,在不打开橡胶塞的情况下,为使装置中的残留气体完全被吸收,应采取的操作是__ 。
(4)为测定铜与H2SO4停止反应时剩余H2SO4的浓度,甲同学进行了如下实验:将反应产生的气体(不含水蒸气)缓慢通过预先称量过的盛有__ 的干燥管,反应结束后再次称量,干燥管质量增加mg。则反应后的溶液中H2SO4的物质的量浓度为__ 。

(1)比较两实验装置,图2装置的优点是①
(2)甲同学依据所学的化学知识认为还有一定量的H2SO4剩余,其理论依据是
(3)乙同学在实验结束后拆除图2装置时,在不打开橡胶塞的情况下,为使装置中的残留气体完全被吸收,应采取的操作是
(4)为测定铜与H2SO4停止反应时剩余H2SO4的浓度,甲同学进行了如下实验:将反应产生的气体(不含水蒸气)缓慢通过预先称量过的盛有
您最近一年使用:0次
2020-09-16更新
|
96次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第三章易错疑难集训(二)
三、填空题 添加题型下试题
填空题
|
较易(0.85)
解题方法
8. 市场上一些看起来非常白而又鲜亮诱人的银耳竟然是用硫黄熏蒸而成的。央视记者暗访银耳变白内幕:工人们不停地对白色银耳进行翻炒,散发出一股刺鼻的气味;一名工人抓起淡黄色块状的东西放进一个小锅里,用火点燃,紧接着把小锅放进有薄膜覆盖的银耳地里。请回答下列问题:
(1)“工人抓起淡黄色块状的东西放进一个小锅里,用火点燃”。其中“淡黄色块状的东西”是__ (写化学式),其在空气中燃烧时火焰的颜色为__ 。该反应的化学方程式为__ 。
(2)用硫黄来熏蒸食品的主要目的是__ (填“增加营养”或“漂白”)。
(3)焦亚硫酸钠是一种食品添加剂,通常为白色或微黄色结晶粉末,其对应的酸是焦亚硫酸,焦亚硫酸可以看作两分子的H2SO3缩掉一分子水而形成的物质,所以焦亚硫酸的分子式为__ ,焦亚硫酸钠在工业上通常是通过将SO2通入饱和碳酸钠溶液中制得的,请写出该反应的化学方程式:__ ,该反应是__ (填“氧化还原反应”或“非氧化还原反应”)。焦亚硫酸钠在水溶液中反应可以生成SO ,所以溶液中存在SO
,所以溶液中存在SO ,由此可推断能够对食品进行漂白、杀菌的有效成分是
,由此可推断能够对食品进行漂白、杀菌的有效成分是__ ,该成分可以与有色物质结合,生成无色物质,该无色物质的特性是__ ,由此可见,食品中该物质超标时,容易导致食用者中毒。
(4)下列食品肯定不会用SO2熏制的是__ (填序号)。
A.色泽鲜艳的干黄花菜 B.苍白亮丽的馒头
C.鲜嫩无比的鲜菠菜 D.晶莹剔透的干鱼片
(5)小明的妈妈在农贸市场买了一些干燥的银耳,颜色为亮丽的白色。可是,一个月后拿出来准备食用时,发现银耳变为暗暗的淡黄色。请你判断该银耳是否用SO2熏蒸过,并说明理由:__ 。
(1)“工人抓起淡黄色块状的东西放进一个小锅里,用火点燃”。其中“淡黄色块状的东西”是
(2)用硫黄来熏蒸食品的主要目的是
(3)焦亚硫酸钠是一种食品添加剂,通常为白色或微黄色结晶粉末,其对应的酸是焦亚硫酸,焦亚硫酸可以看作两分子的H2SO3缩掉一分子水而形成的物质,所以焦亚硫酸的分子式为
 ,所以溶液中存在SO
,所以溶液中存在SO ,由此可推断能够对食品进行漂白、杀菌的有效成分是
,由此可推断能够对食品进行漂白、杀菌的有效成分是(4)下列食品肯定不会用SO2熏制的是
A.色泽鲜艳的干黄花菜 B.苍白亮丽的馒头
C.鲜嫩无比的鲜菠菜 D.晶莹剔透的干鱼片
(5)小明的妈妈在农贸市场买了一些干燥的银耳,颜色为亮丽的白色。可是,一个月后拿出来准备食用时,发现银耳变为暗暗的淡黄色。请你判断该银耳是否用SO2熏蒸过,并说明理由:
您最近一年使用:0次
2020-09-16更新
|
102次组卷
|
2卷引用:鲁科版(2019)高一必修第一册第三章易错疑难集训(二)
试卷分析
整体难度:较易
考查范围:常见无机物及其应用、化学实验基础
试卷题型(共 8题)
题型
数量
单选题
4
解答题
3
填空题
1
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 氯水的性质 二氧化硫的漂白性 二氧化硫与其他强氧化剂的反应 过氧化钠的强氧化性 | |
| 2 | 0.85 | 氯气与还原性化合物的反应 二氧化硫 硫酸盐 二氧化硫的化学性质 | |
| 3 | 0.65 | 漂白粉的变质原因及检验 二氧化硫的漂白性 浓硫酸的吸水性 | |
| 4 | 0.85 | 二氧化硫 二氧化硫的化学性质 酸性氧化物的通性 二氧化硫的漂白性 | |
| 二、解答题 | |||
| 5 | 0.85 | 二氧化硫的制备 化学实验探究 物质性质的探究 | 实验探究题 |
| 6 | 0.85 | 过氧化钠 化学实验探究 物质性质的探究 物质性质实验方案的设计 | 实验探究题 |
| 7 | 0.85 | 浓硫酸的强氧化性 铜与强氧化性酸的反应 化学实验探究 物质性质的探究 | 实验探究题 |
| 三、填空题 | |||
| 8 | 0.85 | 二氧化硫的漂白性 亚硫酸及其盐 | |



