(1)比较给出H+的能力的相对强弱:H2CO3___ C6H5OH(填“>”、“<”或“=”);用一个离子方程式说明CO32‾和C6H5O‾结合H+能力的相对强弱___ 。
(2)Ca(CN)2是离子化合物,各原子均满足8电子稳定结构。写出Ca(CN)2的电子式___ 。
(3)常压下,水晶的硬度比晶体硅的硬度大,其主要原因是___ 。
(2)Ca(CN)2是离子化合物,各原子均满足8电子稳定结构。写出Ca(CN)2的电子式
(3)常压下,水晶的硬度比晶体硅的硬度大,其主要原因是
2020·浙江温州·二模 查看更多[3]
更新时间:2020-06-09 12:51:24
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】在下列物质中:①NaOH ②CH2Cl2 ③PH3 ④Na2O2 ⑤C6H6 ⑥SO3 ⑦SiO2 ⑧[Ag(NH3)2]OH ⑨(NH4)2S ⑩C2H2
(1)其中既含有离子键又含有极性共价键、配位键的化合物是_______ ;
(2)其中既含有离子键又含有非极性共价键的化合物是_______ ;
(3)其中含有极性共价键和非极性共价键的非极性分子是_______ ;
(4)其中含有极性共价键的极性分子是_______ ;
(5)其中含有极性共价键的非极性分子是_______
(1)其中既含有离子键又含有极性共价键、配位键的化合物是
(2)其中既含有离子键又含有非极性共价键的化合物是
(3)其中含有极性共价键和非极性共价键的非极性分子是
(4)其中含有极性共价键的极性分子是
(5)其中含有极性共价键的非极性分子是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________ ;仅发生离子键破坏的是________ ;
(2)既发生离子键破坏、又发生共价键破坏的是______________ ;
(3)N2的电子式为________ ;Na2O2的电子式为________ ;
(4)用电子式表示MgCl2的形成过程_____________
(1)化学键没有被破坏的是
(2)既发生离子键破坏、又发生共价键破坏的是
(3)N2的电子式为
(4)用电子式表示MgCl2的形成过程
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置_______ 。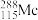 的中子数为
的中子数为_______ 。已知:P(s,白磷)=P(s,黑磷) 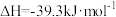 ;P(s,白磷)=P (s,红磷)
;P(s,白磷)=P (s,红磷)  ;由此推知,其中最稳定的磷单质是
;由此推知,其中最稳定的磷单质是_______ 。
(2)氮和磷氢化物性质的比较:热稳定性:NH3_______ PH3(填“>”或“<”)。沸点:N2H4_______ P2H4(填“>”或“<”),判断依据是_______ 。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是___ (填序号)。
a.不能与NaOH反应 b.含离子键 c.含共价键
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式_____ 。
(5)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为_____ 、_____ ,制得等量H2所需能量较少的是____ 。
(1)砷在元素周期表中的位置
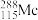 的中子数为
的中子数为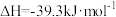 ;P(s,白磷)=P (s,红磷)
;P(s,白磷)=P (s,红磷)  ;由此推知,其中最稳定的磷单质是
;由此推知,其中最稳定的磷单质是(2)氮和磷氢化物性质的比较:热稳定性:NH3
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是
a.不能与NaOH反应 b.含离子键 c.含共价键
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式
(5)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)写出对应元素的名称:A_____ ,C_____ ,E_____ 。
(2)写出下列物质的电子式:
①D元素形成的单质____ ;②A、B、E形成的化合物____ ;③D、E形成的化合物______ 。
(3)A和B可形成A2B、A2B2两种化合物,E与B可形成E2B、E2B2两种化合物,则下列说法不正确的是_____ 。
A.A2B2和E2B2中都含有非极性共价键
B.A2B和E2B都含离子键
C.A2B和A2B2中阴阳离子个数比均为1∶2
D.A2B和A2B2均能溶于E2B,并发生反应
(1)写出对应元素的名称:A
(2)写出下列物质的电子式:
①D元素形成的单质
(3)A和B可形成A2B、A2B2两种化合物,E与B可形成E2B、E2B2两种化合物,则下列说法不正确的是
A.A2B2和E2B2中都含有非极性共价键
B.A2B和E2B都含离子键
C.A2B和A2B2中阴阳离子个数比均为1∶2
D.A2B和A2B2均能溶于E2B,并发生反应
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】人类使用能源经历了三个时期。
(1)柴草时期
从能量转化的角度看,木材燃烧时化学能主要转化成______ 能和光能。
(2)化石能源时期
天然气的主要成分是甲烷,甲烷的电子式为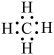 ,其化学键类型是
,其化学键类型是______ (填“离子键”或“共价键”);依据原电池原理,回答下列问题:

如图是使用固体电解质的燃料电池,装置中以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2—(O2+4e—=2O2—)。
①c电极为_______ (填“正”或“负”)极。
②d电极上的电极反应为______ 。
③如果消耗160g甲烷,假设化学能完全转化为电能,则转移电子的数目为______ (用NA表示),需要消耗标准状况下氧气的体积为______ L。
(3)多能源结构时期
可再生能源和清洁能源(绿色能源)将成为新能源的主力军。未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生,下列能源中:①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能,符合未来新能源标准的是_______ 。
(1)柴草时期
从能量转化的角度看,木材燃烧时化学能主要转化成
(2)化石能源时期
天然气的主要成分是甲烷,甲烷的电子式为
 ,其化学键类型是
,其化学键类型是
如图是使用固体电解质的燃料电池,装置中以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2—(O2+4e—=2O2—)。
①c电极为
②d电极上的电极反应为
③如果消耗160g甲烷,假设化学能完全转化为电能,则转移电子的数目为
(3)多能源结构时期
可再生能源和清洁能源(绿色能源)将成为新能源的主力军。未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生,下列能源中:①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能,符合未来新能源标准的是
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】元素在周期表中的位置反映了元素的原子结构和元素的性质。针对下表中的①~⑩种元素,回答以下问题:

(1)第三周期金属元素中原子半径最小的元素为________ (写序号);表中的X元素在第________ 周期第________ 族。
(2)④、⑤分别与①元素组成含10个电子的分子化学式分别为________ 、________ ;
(3)通过单质之间的置换反应,可以比较卤素单质的氧化性强弱。请用离子方程式表示⑧和⑨元素单质的氧化性强弱:________________ ;
(4)用电子式表示②与⑦形成化合物的过程:________________ ;
(5)由①②⑤元素组成的化合物的化学键类型为________ 、________ ;
(6)写出能证明②的金属性强于③的化学事实________ (任写一条)。

(1)第三周期金属元素中原子半径最小的元素为
(2)④、⑤分别与①元素组成含10个电子的分子化学式分别为
(3)通过单质之间的置换反应,可以比较卤素单质的氧化性强弱。请用离子方程式表示⑧和⑨元素单质的氧化性强弱:
(4)用电子式表示②与⑦形成化合物的过程:
(5)由①②⑤元素组成的化合物的化学键类型为
(6)写出能证明②的金属性强于③的化学事实
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)请将下列变化过程中破坏的微粒间作用力名称的编号填在横线上:
A.共价键 B.离子键 C.金属键 D.分子间作用力
①氢氧化钠熔化_____ ;②干冰升华_____ ;
③二氧化硅熔化_____ ;④钠熔化_____ 。
(2)单质硼有无定形和晶体两种,参考下表数据。
①根据表中数据判断晶体硼的晶体类型属于_______ 晶体;
②请解释金刚石的熔沸点高于晶体硅的原因是_________ 。
A.共价键 B.离子键 C.金属键 D.分子间作用力
①氢氧化钠熔化
③二氧化硅熔化
(2)单质硼有无定形和晶体两种,参考下表数据。
| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点(K) | >3823 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 2823 |
| 硬度 | 10 | 7.0 | 9.5 |
①根据表中数据判断晶体硼的晶体类型属于
②请解释金刚石的熔沸点高于晶体硅的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】香花石是我国的矿石“国宝”,其化学组成为Ca3Li2(BeSiO4)3F2。
(1)画出Ca原子最外层电子的轨道示意图______________ ,Ca原子共有______ 种能量不同的电子。
(2)香花石中有四种元素在元素周期表中处于同一周期,将这四种元素按原子半径由大到小排列______________________ ,其中非金属性最强的元素是______________ 。
(3)Be的化学性质与Al相似,将BeCl2溶液蒸干、灼烧,得到的固体物质是________ 。
(4)组成香花石的元素中,可以形成的原子晶体为__________ ,其中熔点较高的是_____ 。
(1)画出Ca原子最外层电子的轨道示意图
(2)香花石中有四种元素在元素周期表中处于同一周期,将这四种元素按原子半径由大到小排列
(3)Be的化学性质与Al相似,将BeCl2溶液蒸干、灼烧,得到的固体物质是
(4)组成香花石的元素中,可以形成的原子晶体为
您最近一年使用:0次

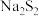 的电子式
的电子式  )熔点为3774℃,而丁硼烷(
)熔点为3774℃,而丁硼烷( )熔点仅
)熔点仅 ℃。氮化硼熔点远高于丁硼烷的可能原因是
℃。氮化硼熔点远高于丁硼烷的可能原因是

