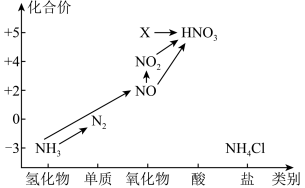
元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。 依据下图中氮元素及其化合物的转化关系,回答下列问题:______________ ;从化合价上看,X 具有_____________ 性(填 “氧化”或“还原”)。
(2)回答下列关于 NH3的问题:
①实验室常用 NH4Cl 与 Ca(OH)2制备氨气,写出该反应的化学方程式_______________________ 。
②下列试剂不能用于干燥NH3的是__________________ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
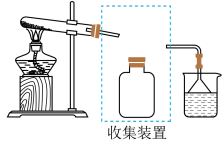
③若要收集一瓶氨气,请将下图装置补充完整,画出虚框内连接图_____________________ 。____________ 。
(3)回答下列关于 NO、NO2 的问题:
①NO 和 NO2按一定比例混合可以被 NaOH 溶液完全吸收,主要反应如下:NO+NO2+2OH-=2 +H2O,2NO2+2OH-=
+H2O,2NO2+2OH-= +
+ +H2O。根据上述反应,NO 和 NO2完全被NaOH溶液吸收时的体积比可能为
+H2O。根据上述反应,NO 和 NO2完全被NaOH溶液吸收时的体积比可能为_______________ (填字母)。
a.=1:1 b.>1:1 c.<1:1
②尾气处理时,下列措施能够提高尾气中NO和NO2去除率的有__________________ 。
A.加快通入尾气的速率 B.采用气、液逆流的方式吸收尾气 C.尾气吸收过程中定期补加适量 NaOH 溶液
(2)回答下列关于 NH3的问题:
①实验室常用 NH4Cl 与 Ca(OH)2制备氨气,写出该反应的化学方程式
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将下图装置补充完整,画出虚框内连接图
(3)回答下列关于 NO、NO2 的问题:
①NO 和 NO2按一定比例混合可以被 NaOH 溶液完全吸收,主要反应如下:NO+NO2+2OH-=2
 +H2O,2NO2+2OH-=
+H2O,2NO2+2OH-= +
+ +H2O。根据上述反应,NO 和 NO2完全被NaOH溶液吸收时的体积比可能为
+H2O。根据上述反应,NO 和 NO2完全被NaOH溶液吸收时的体积比可能为a.=1:1 b.>1:1 c.<1:1
②尾气处理时,下列措施能够提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率 B.采用气、液逆流的方式吸收尾气 C.尾气吸收过程中定期补加适量 NaOH 溶液
更新时间:2020/07/22 18:52:34
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】按要求完成下列各题内容:
(1)写出下列物质的电子式:
①过氧化钠:_______
②氢氧化钠:_____
③二氧化碳:_______
④水:_____
(2)写出下列符合要求的离子方程式 :
①稀硝酸与铜反应:_____
②稀硝酸与硫酸亚铁溶液反应:_____
(3)写出下列符合要求的化学反应方程式:
③碳与浓硝酸反应:_____
④氯化铵与消石灰制氨气:_____
(1)写出下列物质的电子式:
①过氧化钠:
②氢氧化钠:
③二氧化碳:
④水:
(2)写出下列符合要求的
①稀硝酸与铜反应:
②稀硝酸与硫酸亚铁溶液反应:
(3)写出下列符合要求的化学反应方程式:
③碳与浓硝酸反应:
④氯化铵与消石灰制氨气:
您最近一年使用:0次
填空题
|
适中
(0.65)
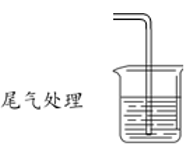
【推荐2】氮气经过一系列反应可以得到硝酸,如图所示:
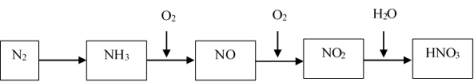
请回答:
(1)用NH3制取NO的化学方程式是___________ 。
(2)NO2易溶于水,写出它与水反应的化学方程式是___________ 。
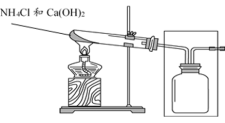
(3)实验室常用如图装置制取并收集氨气。
①试管中反应的化学方程式是___________ 。
②请将方框中的收集装置补充完整。__________
③将蘸有浓盐酸的棉球放在玻璃片上,用集满NH3的集气瓶扣住棉球,可观察到的现象是___________ 。
④甲同学设计了如图所示的装置进行尾气处理,乙同学认为该设计不合理,其理由是___________ 。

请回答:
(1)用NH3制取NO的化学方程式是
(2)NO2易溶于水,写出它与水反应的化学方程式是
(3)实验室常用如图装置制取并收集氨气。

①试管中反应的化学方程式是
②请将方框中的收集装置补充完整。
③将蘸有浓盐酸的棉球放在玻璃片上,用集满NH3的集气瓶扣住棉球,可观察到的现象是
④甲同学设计了如图所示的装置进行尾气处理,乙同学认为该设计不合理,其理由是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】下列是中学化学常见气体:①二氧化硫②氨气③氯化氢④氯气,回答下列问题:
(1)上述气体属于非电解质有_______ (填序号)。
(2)上述气体的实验室制法中,属于固液加热型发生装置的有_______ (填序号),必须用防倒吸装置吸收尾气的有_______ (填序号)。
(3)上述气体中只能使紫色石蕊试液变红的有_______ (填序号)。
(4)将上述气体中能使品红溶液褪色的气体等体积混合后再通入品红溶液,观察到的现象是_______ ,其原因是_______ (用离子方程式表示)。
(5)大气固氮的反应条件为_______ 。该反应产物在一定条件下能与上述气体中的含氮化合物反应生成对环境友好的物质,写出该反应的化学方程式_______ 。
(1)上述气体属于非电解质有
(2)上述气体的实验室制法中,属于固液加热型发生装置的有
(3)上述气体中只能使紫色石蕊试液变红的有
(4)将上述气体中能使品红溶液褪色的气体等体积混合后再通入品红溶液,观察到的现象是
(5)大气固氮的反应条件为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】非金属元素在生产生活中扮演着重要角色。请根据题意填空;
(1)氨是一种极易溶于水的气体,其水溶液能使酚酞溶液变_______ (填“红”或“蓝”);
(2)SO2有一定的还原性,在葡萄酒的酿制过程中,添加适量的SO2,除可杀菌外,还可防止葡萄酒中的一些成分被_______ (填“氧化”或“还原”),起到保质作用;
(3)玻璃中的成分SiO2能与NaOH溶液反应: ,实验室中盛放NaOH溶液应选用带
,实验室中盛放NaOH溶液应选用带_______ (填“玻璃塞”或“橡胶塞”)的试剂瓶。
(1)氨是一种极易溶于水的气体,其水溶液能使酚酞溶液变
(2)SO2有一定的还原性,在葡萄酒的酿制过程中,添加适量的SO2,除可杀菌外,还可防止葡萄酒中的一些成分被
(3)玻璃中的成分SiO2能与NaOH溶液反应:
 ,实验室中盛放NaOH溶液应选用带
,实验室中盛放NaOH溶液应选用带
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的 排放。
排放。
(1)SCR(选择性催化还原)工作原理如图所示: 水溶液热分解为
水溶液热分解为 和
和 ,该反应的化学方程式;
,该反应的化学方程式;_____________________ 。
②反应器中 还原
还原 的化学方程式:
的化学方程式:_________________________________ 。
③当燃油中含硫量较高时,尾气中 在
在 作用下会形成
作用下会形成 ,使催化剂中毒。用化学方程式表示
,使催化剂中毒。用化学方程式表示 的形成:
的形成:___________________________________________________ 。
④尿素溶液浓度影响 的转化,测定溶液中尿素(
的转化,测定溶液中尿素(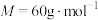 )含量的方法如下:取
)含量的方法如下:取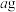 尿素溶液,将所含氮完全转化为
尿素溶液,将所含氮完全转化为 ,所得
,所得 用过量的
用过量的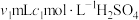 溶液吸收完全,剩余
溶液吸收完全,剩余 用
用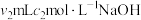 溶液恰好中和,则尿素溶液中溶质的质量分数是
溶液恰好中和,则尿素溶液中溶质的质量分数是_____________ 。
(2)NSR( 储存还原)工作原理:
储存还原)工作原理:
 的储存和还原在不同时段交替进行,如图所示。
的储存和还原在不同时段交替进行,如图所示。 的相互转化实现
的相互转化实现 的储存和还原。储存
的储存和还原。储存 的物质是
的物质是__________ 。
②用 模拟尾气中还原性气体研究了
模拟尾气中还原性气体研究了 的催化还原过程,该过程分两步进行,图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的
的催化还原过程,该过程分两步进行,图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的 与
与 的物质的量之比是
的物质的量之比是___________________ 。
 排放。
排放。(1)SCR(选择性催化还原)工作原理如图所示:
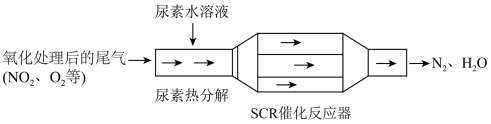
 水溶液热分解为
水溶液热分解为 和
和 ,该反应的化学方程式;
,该反应的化学方程式;②反应器中
 还原
还原 的化学方程式:
的化学方程式:③当燃油中含硫量较高时,尾气中
 在
在 作用下会形成
作用下会形成 ,使催化剂中毒。用化学方程式表示
,使催化剂中毒。用化学方程式表示 的形成:
的形成:④尿素溶液浓度影响
 的转化,测定溶液中尿素(
的转化,测定溶液中尿素(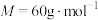 )含量的方法如下:取
)含量的方法如下:取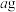 尿素溶液,将所含氮完全转化为
尿素溶液,将所含氮完全转化为 ,所得
,所得 用过量的
用过量的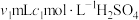 溶液吸收完全,剩余
溶液吸收完全,剩余 用
用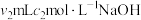 溶液恰好中和,则尿素溶液中溶质的质量分数是
溶液恰好中和,则尿素溶液中溶质的质量分数是(2)NSR(
 储存还原)工作原理:
储存还原)工作原理: 的储存和还原在不同时段交替进行,如图所示。
的储存和还原在不同时段交替进行,如图所示。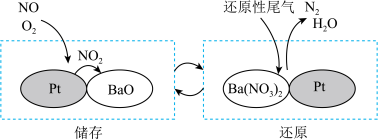
 的相互转化实现
的相互转化实现 的储存和还原。储存
的储存和还原。储存 的物质是
的物质是②用
 模拟尾气中还原性气体研究了
模拟尾气中还原性气体研究了 的催化还原过程,该过程分两步进行,图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的
的催化还原过程,该过程分两步进行,图表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的 与
与 的物质的量之比是
的物质的量之比是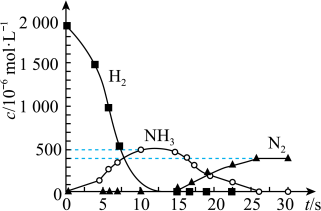
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】五种短周期元素的某些性质如表所示(请用相应的元素符号或化学式作答)
(1)R元素在元素周期表中的位置∶第_______ 周期,第_______ 族。
(2)用电子式表示W与Y形成化合物W2Y的过程_______
(3)Q、W、Y的离子半径由大到小的顺序为_______ ,1molR4中含有共价键数目为_______ 。
(4)X2Z2的结构式_______ ,WYZ的电子式_______ 。
(5)W3Q与WZ还原性强弱为W3Q_______ WZ(填">"、"<"或"="),WZ溶于Z2Y的化学方程式为_______ 。
(6)Z2Y2能使硫酸酸化的KMnO4溶液褪色,写出该反应的离子方程式_______ 。
| 元素 | 元素的相关信息 |
| Q | 最高价氧化物对应的水化物能与其气态氢化物发生化合反应生成盐 |
| R | 其最高价和最低价的代数和为2 |
| W | 在短周期元素中,其原子半径最大 |
| X | 其原子的最外层电子数是次外层电子数的2倍, Y是地壳中含量最多的元素 |
| Z | 是元素周期表中原子半径最小的元紫 |
(2)用电子式表示W与Y形成化合物W2Y的过程
(3)Q、W、Y的离子半径由大到小的顺序为
(4)X2Z2的结构式
(5)W3Q与WZ还原性强弱为W3Q
(6)Z2Y2能使硫酸酸化的KMnO4溶液褪色,写出该反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(1)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式________________ 。
(2)煤燃烧时排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NO的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下表所示(其他极微量离子忽略不计):
①NO和NaClO2溶液反应的离子方程式是________________ 。
②表中y=___________________ 。
(3)工业生产硝酸也有可能产生NOx污染。请写出硝酸生产中的第一步:氨的催化氧化的化学方程式为__________________ 。若用氮气制氨的产率为90%,用氨生产硝酸时氨的催化氧化和氮氧化物转化为硝酸的损耗依次为5%、5%,则1000 mol氮气可制得_______________ (计算结果保留整数)mol硝酸。
(1)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式
(2)煤燃烧时排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NO的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下表所示(其他极微量离子忽略不计):
| 离子 | Na+ |  |  | H+ | C1- |
| 浓度/(mol/L) | 5.5×10-3 | 8.5×10-4 | y | 2.8×10-4 | 3.5×10-3 |
①NO和NaClO2溶液反应的离子方程式是
②表中y=
(3)工业生产硝酸也有可能产生NOx污染。请写出硝酸生产中的第一步:氨的催化氧化的化学方程式为
您最近一年使用:0次
【推荐2】1.亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___________ ___________
___________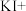 ___________=___________
___________=___________ ___________
___________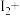 ___________
___________ ___________
___________
___ 
(1)请完成该化学方程式并配平。___________
(2)将上述反应方程式改写为离子反应方程式:___________ 。
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)简便鉴别亚硝酸钠和氯化钠的方法是___________ 。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:___________
 ___________
___________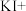 ___________=___________
___________=___________ ___________
___________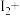 ___________
___________ ___________
___________

(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)简便鉴别亚硝酸钠和氯化钠的方法是
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式,并用单线桥表示其电子转移的方向和数目:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】十九大报告指出:“建设生态文明是中华民族永续发展的千年大计”。控制和治理NOx、SO2、CO2是解决光化学烟雾、减少酸雨和温室效应的有效途径,对构建生态文明有着极为重要的意义。请回答下列问题:
(1)利用SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
①SCR(选择催化还原NOx)工作原理:
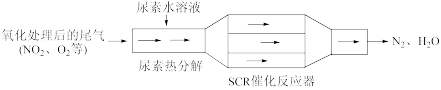
尿素水溶液热分解为NH3和CO2的化学方程式为______________________ ,SCR催化反应器中NH3还原NO2的化学方程式为________________________ 。
②NSR(NOx储存还原)工作原理:
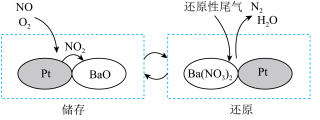
在储存过程中,NO发生的总化学反应方程式为_____________________ 。
(2)双碱法除去SO2的工作原理:NaOH溶液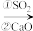 Na2SO3溶液过程①的离子方程式为
Na2SO3溶液过程①的离子方程式为_________________________ ;
CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s) Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理:
Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理:_______________________ 。
(1)利用SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
①SCR(选择催化还原NOx)工作原理:

尿素水溶液热分解为NH3和CO2的化学方程式为
②NSR(NOx储存还原)工作原理:

在储存过程中,NO发生的总化学反应方程式为
(2)双碱法除去SO2的工作原理:NaOH溶液
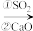 Na2SO3溶液过程①的离子方程式为
Na2SO3溶液过程①的离子方程式为CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s)
 Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理:
Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】研究氮的循环和转化对生产、生活有重要的价值。
I.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。_______ 。
(2)设备2中通入的NO与A反应生成红棕色气体,该气体再与水反应生成硝酸,该过程中发生反应的化学方程式依次为_______ 、_______ 。
(3)若1molNH3经过以上流程恰好完全反应生成NH4NO3,则过程中参与反应的O2的物质的量为_______ 。
II.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH 和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
含NH 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水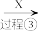 达标。
达标。
(4)过程①的目的是将NH 转化为NH3,该过程中鼓入大量空气的目的是
转化为NH3,该过程中鼓入大量空气的目的是_______ 。
(5)过程②加入NaClO溶液可将氨氮物质转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为_______ 、_______ 。
(6)含余氯废水的主要成分是NaClO,X可选用Na2SO3将其除去,写出其离子反应方程式_______ 。
I.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。

(2)设备2中通入的NO与A反应生成红棕色气体,该气体再与水反应生成硝酸,该过程中发生反应的化学方程式依次为
(3)若1molNH3经过以上流程恰好完全反应生成NH4NO3,则过程中参与反应的O2的物质的量为
II.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH
 和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:含NH
 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水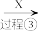 达标。
达标。(4)过程①的目的是将NH
 转化为NH3,该过程中鼓入大量空气的目的是
转化为NH3,该过程中鼓入大量空气的目的是(5)过程②加入NaClO溶液可将氨氮物质转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为
(6)含余氯废水的主要成分是NaClO,X可选用Na2SO3将其除去,写出其离子反应方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】下图是氮元素的各种价态与物质类别的对应关系:
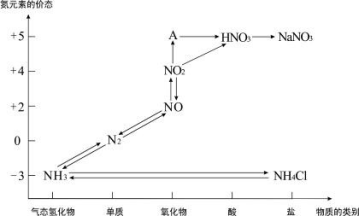
(1)根据 A 对应的化合价和物质类别,A 的摩尔质量是______ g·mol-1,从氮元素的 化合价能否发生变化的角度判断,图中既有 氧化性又有还原性的化合物有_____________ 。
(2)汽车尾气中含有 CO 和 NOx 等多种有 害气体,若在汽车的排气管上安装一种催化 转化装置,可使 CO 与 NO 反应,生成两种 无毒气体,则该反应的化学方程式为________________________________________ 。

(1)根据 A 对应的化合价和物质类别,A 的摩尔质量是
(2)汽车尾气中含有 CO 和 NOx 等多种有 害气体,若在汽车的排气管上安装一种催化 转化装置,可使 CO 与 NO 反应,生成两种 无毒气体,则该反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】化学在治理空气污染方面发挥着重要的作用。
I.化石燃料的过度使用是导致酸雨的主要原因。研究表明,NOx、SO2形成酸雨时的转化关系如图所示:
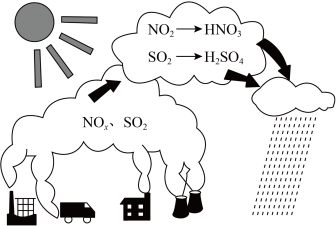
(1)HNO3的电离方程式为_______ 。
(2)SO2会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是_______ (用化学方程式表示)。
Ⅱ.NOx、SO2等均为大气污染物,需处理后才能排放。
(3)用NaOH溶液可以吸收NOx,反应的化学方程式如下:
i.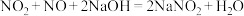
ii.
①反应i中,每消耗0.3molNO2,转移电子数为_______ 。
②反应ii中,氧化剂和还原剂的物质的量之比为_______ 。
(4)用氨水可以吸收SO2制取铵盐。
①实验室制取NH3的化学方程式为_______ 。
②用足量氨水吸收SO2的化学方程式为_______ 。
(5)利用NaClO吸收液可在脱除烟气中NOx的同时脱除SO2,研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。
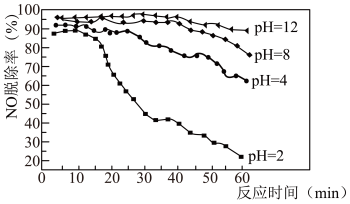
pH=2时,脱除SO2的离子方程式为_______ ;脱硝效率随反应时间的延长而逐渐降低的可能原因是_______ 。
I.化石燃料的过度使用是导致酸雨的主要原因。研究表明,NOx、SO2形成酸雨时的转化关系如图所示:

(1)HNO3的电离方程式为
(2)SO2会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是
Ⅱ.NOx、SO2等均为大气污染物,需处理后才能排放。
(3)用NaOH溶液可以吸收NOx,反应的化学方程式如下:
i.
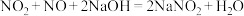
ii.

①反应i中,每消耗0.3molNO2,转移电子数为
②反应ii中,氧化剂和还原剂的物质的量之比为
(4)用氨水可以吸收SO2制取铵盐。
①实验室制取NH3的化学方程式为
②用足量氨水吸收SO2的化学方程式为
(5)利用NaClO吸收液可在脱除烟气中NOx的同时脱除SO2,研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。

pH=2时,脱除SO2的离子方程式为
您最近一年使用:0次



