“84消毒液”是日常生活中常用的消毒液,在抗击新冠肺炎中广泛应用。
(1)“84消毒液”的有效成分为________ ;
(2)“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行_________ (填“是"或“否”),原因是_____________ ;
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是________ (填化学式);工业上ClO2常用NaClO3和Na2SO3溶液混合酸化反应制得,反应中NaClO3和Na2SO3的物质的量之比为__________ 。
(1)“84消毒液”的有效成分为
(2)“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是
更新时间:2020-07-31 02:21:36
|
相似题推荐
【推荐1】回答下列问题。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(1)请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
(2)请将上述反应改写成离子方程式___________ 。
(3)浓盐酸在反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生 71g Cl2,则被氧化的 HCl 为___________ g。
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比 Cl2、O2、ClO2、KMnO4 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH 至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________ 。(填化学式)
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:__________ 。
②每生成1个FeO 转移
转移___________ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)请将上述反应改写成离子方程式
(3)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生 71g Cl2,则被氧化的 HCl 为
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比 Cl2、O2、ClO2、KMnO4 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH 至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个FeO
 转移
转移
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】化学工业为疫情防控提供了强有力的物质支撑。
(I)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________ (填序号)。
A Cl2 B H2O2 C ClO2 D O3
(II)一氯胺(NH2Cl)在中性或酸性环境中会发生强烈水解,生成具有强烈杀菌作用的HClO,是重要的水消毒剂。
(1)写出NH2Cl的电子式_______________
(2)写出NH2Cl水解的化学方程式______________________
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为__________
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_________ (用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________________
(I)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是
A Cl2 B H2O2 C ClO2 D O3
(II)一氯胺(NH2Cl)在中性或酸性环境中会发生强烈水解,生成具有强烈杀菌作用的HClO,是重要的水消毒剂。
(1)写出NH2Cl的电子式
(2)写出NH2Cl水解的化学方程式
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】氮及其化合物在工、农业等领域占据重要地位,但其氮氧化物(NOx)也会造成酸雨、光化学烟雾等环境污染问题。回答下列问题:
(1)图是自然界中氮循环示意图:

①根据上图,分别写出人工固氮和自然固氮(雷电作用)的化学方程式:_______ ;_______ 。
②亚硝酸盐和铵盐反应可生成氮气。如反应: 。该反应中,每生成6.72L(标准状况下)N2,转移
。该反应中,每生成6.72L(标准状况下)N2,转移_______ mol电子。
③根据上图,下列说法正确的是_______ (填字母)。
A.氮元素均被氧化
B.含氮无机物和含氮有机物可相互转化
C.氮、氢、氧三种元素均参与了氮循环
(2)NOx是汽车尾气中的主要污染物之一、在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_______ 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下: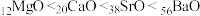 。其原因是
。其原因是_______ ,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
③氮氧化物(NOx)与悬浮在大气中的海盐粒子相互作用时,发生反应: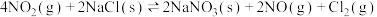 。上述反应可以视作分两步进行:第1步:
。上述反应可以视作分两步进行:第1步:_______ ;第2步: 。
。
④NaClO溶液可吸收硝酸工业尾气中的NOx。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀硫酸调节)的减小而增大。在酸性NaClO溶液中,HClO氧化NO生成
的转化率随NaClO溶液初始pH(用稀硫酸调节)的减小而增大。在酸性NaClO溶液中,HClO氧化NO生成 和
和 的离子方程式为
的离子方程式为
_______ ;简述NaClO溶液的初始pH越小,NO转化率越高的原因:_______ 。
(1)图是自然界中氮循环示意图:

①根据上图,分别写出人工固氮和自然固氮(雷电作用)的化学方程式:
②亚硝酸盐和铵盐反应可生成氮气。如反应:
 。该反应中,每生成6.72L(标准状况下)N2,转移
。该反应中,每生成6.72L(标准状况下)N2,转移③根据上图,下列说法正确的是
A.氮元素均被氧化
B.含氮无机物和含氮有机物可相互转化
C.氮、氢、氧三种元素均参与了氮循环
(2)NOx是汽车尾气中的主要污染物之一、在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:
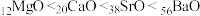 。其原因是
。其原因是③氮氧化物(NOx)与悬浮在大气中的海盐粒子相互作用时,发生反应:
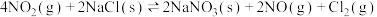 。上述反应可以视作分两步进行:第1步:
。上述反应可以视作分两步进行:第1步: 。
。④NaClO溶液可吸收硝酸工业尾气中的NOx。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀硫酸调节)的减小而增大。在酸性NaClO溶液中,HClO氧化NO生成
的转化率随NaClO溶液初始pH(用稀硫酸调节)的减小而增大。在酸性NaClO溶液中,HClO氧化NO生成 和
和 的离子方程式为
的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】碱式氯化铜是重要的无机杀菌剂。碱式氯化铜有多种制备方法:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为_______ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。
有关物质的部分性质如下表:
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1) 仪器A冷却水的进口为________ (填“a”或“b”)。
(2) 仪器B中盛放的药品是________ 。
(3) 实验时,装置丁中发生反应的离子方程式为________ 。
(4) 装置丙的作用为______ ,若缺少装置乙硫酰氯会水解,该反应的化学方程式为_______ 。
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是________ 。
有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1) 仪器A冷却水的进口为
(2) 仪器B中盛放的药品是
(3) 实验时,装置丁中发生反应的离子方程式为
(4) 装置丙的作用为
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】铁是人体含量最多的微量元素,这些铁在人体中不是以金属单质的形式存在,而是以 和
和 的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。回答下列问题:
的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中只有还原性的是______ (填字母)。
A. Fe B. C.
C. 
(2)工业盐的主要成分是 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有______ 性(填“氧化”或“还原”)。下列不能实现这种转化的物质是______ (填字母)。
A.Fe B. C.
C. D.浓硫酸
D.浓硫酸
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有______ 性(填“氧化”或“还原”)。
(4)在 的反应中,还原剂是
的反应中,还原剂是____________ ,每有56g Fe参加反应,被还原的 的质量是
的质量是______ g,用单线桥法标出该反应的电子转移情况____________ 。
(5) 是一种浅绿色晶体,俗称绿矾,绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为
是一种浅绿色晶体,俗称绿矾,绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为 )来制取,已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式
)来制取,已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式____________ 。
 和
和 的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。回答下列问题:
的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。回答下列问题:(1)以下为常见的铁元素的几种微粒,其中只有还原性的是
A. Fe B.
 C.
C. 
(2)工业盐的主要成分是
 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有A.Fe B.
 C.
C. D.浓硫酸
D.浓硫酸(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有
(4)在
 的反应中,还原剂是
的反应中,还原剂是 的质量是
的质量是(5)
 是一种浅绿色晶体,俗称绿矾,绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为
是一种浅绿色晶体,俗称绿矾,绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为 )来制取,已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式
)来制取,已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.工业上常用氯气与石灰乳反应制漂白粉,但Ca(OH)2与Cl2反应的氧化产物与温度有关。在足量的石灰乳中通入一定量的氯气,充分反应后生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
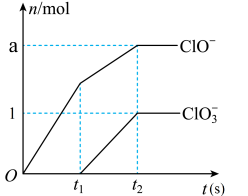
(1)常温时工业制漂白粉的化学方程式为_________________ 。
(2)t1时开始有ClO3-生成的原因是_________________ 。
(3)该石灰乳中参加反应的Ca(OH)2的物质的量是_________________ mol(用含a的代数式来表示)。
Ⅱ.过氧乙酸( )是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(4)下列叙述正确的是_________________ (填字母)。
A.过氧乙酸分子中两个氧原子化合价为-1,一个氧原子化合价为-2
B.过氧乙酸溶于水能导电,属于离子化合物,也属于电解质
C.过氧乙酸包装上应贴的危险警告标签应如图所示
D.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
E.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)某学生在实验室用3.00 mol•L−1过氧乙酸配制0.15 mol•L−1过氧乙酸溶液250 mL,该生用量筒量取工业品过氧乙酸的体积为_________________ mL。
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-,请选择下列试剂按照加入先后顺序填空_________________ (试剂不必选完,填序号)。
①醋酸钡溶液;②醋酸;③硝酸钡溶液;④盐酸;⑤碳酸氢钠溶液;⑥碳酸钠溶液。

(1)常温时工业制漂白粉的化学方程式为
(2)t1时开始有ClO3-生成的原因是
(3)该石灰乳中参加反应的Ca(OH)2的物质的量是
Ⅱ.过氧乙酸(
 )是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。(4)下列叙述正确的是
A.过氧乙酸分子中两个氧原子化合价为-1,一个氧原子化合价为-2
B.过氧乙酸溶于水能导电,属于离子化合物,也属于电解质
C.过氧乙酸包装上应贴的危险警告标签应如图所示

D.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
E.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)某学生在实验室用3.00 mol•L−1过氧乙酸配制0.15 mol•L−1过氧乙酸溶液250 mL,该生用量筒量取工业品过氧乙酸的体积为
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-,请选择下列试剂按照加入先后顺序填空
①醋酸钡溶液;②醋酸;③硝酸钡溶液;④盐酸;⑤碳酸氢钠溶液;⑥碳酸钠溶液。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】NaCl是一种化工原料,可以制备多种物质,如图所示。
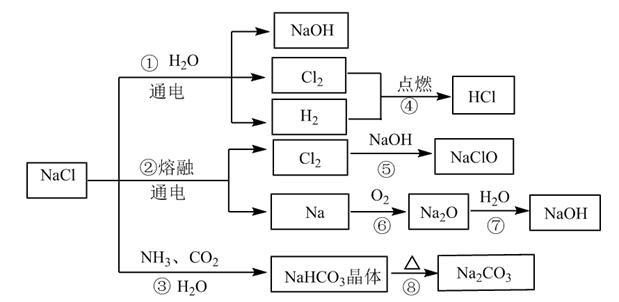
请回答下列问题:
(1)图所列物质中属于电解质的有___________ 种,转化反应中属于氧化还原反应的有___________ (填图中序号)
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是___________ 。
(3)反应④的现象是___________ ;反应⑤的化学方程式为___________ 。
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=___________ mol/L(结果保留两位小数);“84消毒液”不能与“洁厕灵(主要成分是HCl)”混合使用,否则会产生黄绿色的有毒气体引起安全事故,其反应的离子方程式是___________ 。

请回答下列问题:
(1)图所列物质中属于电解质的有
(2)工业上制取NaOH主要采用反应①,而不采用反应⑦的方法,主要原因是
(3)反应④的现象是
(4)NaClO是“84消毒液”的有效成分,在抗击新冠肺炎疫情中发挥了重要作用。某同学购买了一瓶某品牌的“84消毒液”,查看相关资料及包装说明可获得以下信息:原液净含量为600g、密度约为1.1g/cm3、有效成分NaClO的质量分数约为1.9%(通过有效氯含量折算而得)。该同学从中取出100mL原液,按包装说明稀释30倍(体积之比)后用于家庭一般物体表面消毒,稀释后的溶液中c(NaClO)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】由氢气和氯气组成的混合气体,经光照充分反应后,通入100mL1molLNaOH溶液中,溶液中某种离子的物质的量(图甲)和溶液的导电性(图乙)随着反应后的混合气体通入体积的变化而变化。
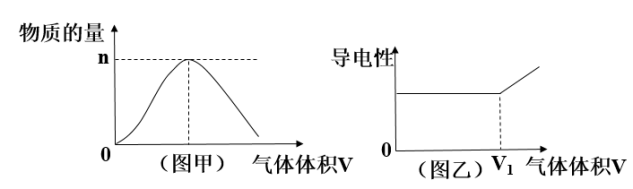
(1)图甲曲线表示溶液中___________ 离子的变化。
(2)对溶液进行导电性实验时,发现当通入的光照反应后的混合气体体积大于V1时,随着混合气体的通入,溶液导电性明显增强,引起导电性增强的主要正、负离子是___________ 。
(3)当图甲中n=0.01mol时,则光照前的混合气体中H2和Cl2的物质的量之比为___________ 。(书写必要步骤)

(1)图甲曲线表示溶液中
(2)对溶液进行导电性实验时,发现当通入的光照反应后的混合气体体积大于V1时,随着混合气体的通入,溶液导电性明显增强,引起导电性增强的主要正、负离子是
(3)当图甲中n=0.01mol时,则光照前的混合气体中H2和Cl2的物质的量之比为
您最近一年使用:0次



