A、B、C是短周期ⅠA和ⅡA族元素的碳酸正盐,它们的质量分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:___ 。
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式___ 。
(3)A的正确选择有___ 种,其化学式为:___ 。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式
(3)A的正确选择有
更新时间:2020-08-24 10:48:15
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】某种胃药的有效成分为碳酸钙测定其中碳酸钙含量的操作如下(该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸。
请回答下列问题。
(1)正确的操作顺序是___________ (填序号)。
(2)测定过程中发生的离子方程式为:___________ ;___________ 。
(3)该测定实验共进行了4次。实验室有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格为___________ ,理由是___________ 。
(4)下列配制的稀盐酸溶液和NaOH溶液浓度偏高的是___________。
(5)某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中的碳酸钙的质量分数___________ 。(写出计算过程)
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸。
请回答下列问题。
(1)正确的操作顺序是
(2)测定过程中发生的离子方程式为:
(3)该测定实验共进行了4次。实验室有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制稀盐酸应选用的容量瓶规格为
(4)下列配制的稀盐酸溶液和NaOH溶液浓度偏高的是___________。
| A.配制盐酸用量筒量取盐酸时俯视刻度线 |
| B.配制盐酸定容时,仰视容量瓶刻度线 |
| C.称量4gNaOH配制0.10mol/LNaOH溶液1000mL时,砝码错放左盘 |
| D.NaOH溶解后立即注入容量瓶至刻度线 |
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.00 | 12.90 | 13.10 | 16.00 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】已知:①铜矿石中含有Cu2(OH)2CO3及含铁元素的杂质;
②黄铵铁矾的化学式为(NH4)x(SO4)m(OH)n,其中铁为+3价。
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图:

(1)过滤要用到的玻璃仪器有:烧杯、玻璃棒、_____ 。
(2)检验溶液A中的Fe3+常用的试剂是______ 溶液(填化学式)。
(3)向含Fe2+的盐溶液中加入NaOH溶液,可观察到白色絮状沉淀迅速转为灰绿色,最终转为红褐色沉淀,请写出白色絮状沉淀最终转为红褐色沉淀所涉及的化学方程式_____ 。
(4)黄铵铁矾高温下分解可得到一种红棕色固体,该红棕色固体的化学式为______ 。
(5)H2O2可以将Fe2+转化成Fe3+,请写出酸性条件下该反应的离子方程式_____ ;但温度过高时,Fe2+转化率下降,其原因是_____ 。
(6)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取ag样品,加盐酸完全溶解后,将所得溶液分为两等份;
b.向一份中加入足量NaOH溶液并加热,收集到标准状况下112mL的气体(发生反应:NH +OH
+OH NH3↑+H2O,假设气体全部逸出);将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.60g;
NH3↑+H2O,假设气体全部逸出);将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.60g;
c.向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀2.33g。
①黄铵铁矾中SO 与Fe3+的个数比为
与Fe3+的个数比为______ 。
②通过计算确定黄铵铁矾的化学式______ 。
②黄铵铁矾的化学式为(NH4)x(SO4)m(OH)n,其中铁为+3价。
某兴趣小组利用该铜矿石制黄铵铁矾的流程如图:

(1)过滤要用到的玻璃仪器有:烧杯、玻璃棒、
(2)检验溶液A中的Fe3+常用的试剂是
(3)向含Fe2+的盐溶液中加入NaOH溶液,可观察到白色絮状沉淀迅速转为灰绿色,最终转为红褐色沉淀,请写出白色絮状沉淀最终转为红褐色沉淀所涉及的化学方程式
(4)黄铵铁矾高温下分解可得到一种红棕色固体,该红棕色固体的化学式为
(5)H2O2可以将Fe2+转化成Fe3+,请写出酸性条件下该反应的离子方程式
(6)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取ag样品,加盐酸完全溶解后,将所得溶液分为两等份;
b.向一份中加入足量NaOH溶液并加热,收集到标准状况下112mL的气体(发生反应:NH
 +OH
+OH NH3↑+H2O,假设气体全部逸出);将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.60g;
NH3↑+H2O,假设气体全部逸出);将所得沉淀过滤、洗涤、灼烧至恒重,得到红棕色粉末0.60g;c.向另一份中加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀2.33g。
①黄铵铁矾中SO
 与Fe3+的个数比为
与Fe3+的个数比为②通过计算确定黄铵铁矾的化学式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】化学教材后的元素周期表为通用元素周期表,2019年是门捷列夫提出元素周期表诞生150周年,联合国宣布2019年为“国际化学元素周期表年”。同年,欧洲化学学会(EuChemS)发布了1张“扭曲”的元素周期表,指出:由于过度使用,部分元素可能在未来的100年内从地球上消失。每种元素在周期表上所占面积的大小,呈现出元素的稀缺程度。___________ ;④是手机电池的主要构成元素,④的单质在③的常见单质中点燃的方程式为___________ 。
(2)用电子式表示①与③形成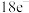 化合物的过程:
化合物的过程:___________ 。
(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有___________ (填序号)。___________ 。
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为___________ 。
② 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与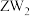 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式___________ 。
(2)用电子式表示①与③形成
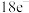 化合物的过程:
化合物的过程:(3)①和②能形成多种化合物,下图模型表示的分子中,不可能由①②形成的有
a. 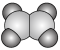 b.
b.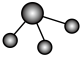 c.
c. 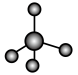 d.
d.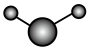
(5)一种新型除草剂的结构如下图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M与Z同主族,W是最不稀缺的元素。
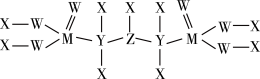
 与NaOH溶液反应只生成一种盐,则
与NaOH溶液反应只生成一种盐,则 与足量NaOH溶液反应的离子方程式为
与足量NaOH溶液反应的离子方程式为②
 可做火箭推进剂的燃料,优点之一是其与
可做火箭推进剂的燃料,优点之一是其与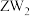 反应的产物绿色无污染,请写出相应的化学方程式
反应的产物绿色无污染,请写出相应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
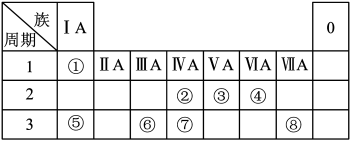
(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)②的最高价氧化物的分子式为___________ ;⑦的最高价氧化物对应水化物的分子式为___________ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:___________ 、___________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
(5)半径大小比较:③___________ ④;金属性强弱比较:⑤___________ ⑥(填“>”、“<”或“=”)。
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为___________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的分子式为
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
| A.最高正化合价为+6 | B.气态氢化物比 稳定 稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
(5)半径大小比较:③
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】已知A、B、C、D四种元素分别为短周期元素,表示中三个不同短周期的主族元素,且原子序数依次增
大。D原子的质子数是B原子质子数的2倍,A原子与D原子的最外层电子数之和是B原子与C原子质子
数之和的1/3。A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)D元素的名称____________ ,C元素在元素周期表中的位置_____________ 。
(2)写出BA3的电子式____________ ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式________________________________ 。
(3)D单质在工业上最重要的用途是_________ ,写出工业上制取D单质的化学方程式__________ 。
(4)在实验室中B的最高价氧化物的水化物的浓溶液应如何保存__________________ ,用化学方程
式说明理由____________________________________ 。
大。D原子的质子数是B原子质子数的2倍,A原子与D原子的最外层电子数之和是B原子与C原子质子
数之和的1/3。A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)D元素的名称
(2)写出BA3的电子式
(3)D单质在工业上最重要的用途是
(4)在实验室中B的最高价氧化物的水化物的浓溶液应如何保存
式说明理由
您最近一年使用:0次



